摘要:本文報道了首項評估系統性給藥工程化細胞外囊泡(EV)ILB-202的I期臨床試驗。
核因子κB(NF-κB)的過度激活在多種炎癥性和自身免疫性疾病的發病機制中起著核心作用。然而,傳統的NF-κB抑制劑存在特異性差、導致廣泛免疫抑制等局限性。細胞外囊泡(Extracellular Vesicles, EVs)作為一種新興的治療性載體,具有天然的低復制風險、低腫瘤發生風險和良好的生物相容性優勢,為精準遞送治療性 cargo 提供了新途徑。ILB-202是一種經過工程化改造的異體EV,來源于HEK293細胞,并裝載了一種半衰期延長的、穩定的NF-κB抑制蛋白——超級抑制因子IκBα(super-repressor IκBα, srIκB)。其設計理念是在NF-κB病理性地高度激活的細胞中優先發揮抑制作用,而對健康細胞的正常生理功能影響極小。本研究旨在通過一項首次人體(First-in-human)試驗,評估單次靜脈注射遞增劑量ILB-202在健康志愿者中的短期安全性、耐受性及初步藥效學效應。

圖1 一種用于抑制NF-κB的工程化細胞外囊泡ILB-202的安全性與抗炎效果:雙盲、隨機、安慰劑對照的I期臨床試驗
研究方法
這是一項在澳大利亞單一研究中心進行的隨機、雙盲、安慰劑對照的I期劑量遞增研究(ILIAS研究ILB-202-001)。研究共設置了三個劑量組(Cohort 1-3),劑量水平分別為0.3、1.2和5.2 × 1010顆粒/千克(particles/kg),基于臨床前大鼠和犬的毒理學研究數據以及多種疾病模型(如急性腎損傷IRI模型、類風濕性關節炎、早產模型等)中的藥理活性劑量(PAD)確定。每個隊列隨機分配6名健康志愿者(4人接受ILB-202,2人接受安慰劑),共18人完成研究。ILB-202通過2小時靜脈輸注給藥。主要終點是評估安全性(不良事件、生命體征、實驗室檢查、心電圖等)和耐受性。關鍵的探索性終點包括通過流式細胞術分析免疫細胞亞群(CD4+、CD8+、CD19+、CD16/56+ NK細胞)的變化,以及利用單細胞RNA測序(scRNA-seq)對給藥前(Pre)、輸注結束時(EOI)和輸注后24小時(24h)采集的外周血單核細胞(PBMCs)進行轉錄組學分析,以深入探究ILB-202的分子機制和藥效學影響。
研究結果
安全性及耐受性
ILB-202在所有測試劑量下均表現出良好的安全性和耐受性。未發生死亡、嚴重不良事件(SAEs)或劑量限制性毒性(DLTs)。共報告了15例治療期出現的不良事件(TEAEs),發生在12名受試者中,絕大多數為1級(輕度)嚴重程度。唯一一例2級事件(輸注部位疼痛)發生在安慰劑組。實驗室參數、生命體征和細胞因子譜(IL-1β, IL-2, IL-6, IL-10, IFN-γ, TNF-α)及C反應蛋白(CRP)在24小時內保持穩定,未觀察到全身性免疫原性或細胞因子釋放綜合征(CRS)的跡象。值得注意的是,在中、高劑量組觀察到自然殺傷(NK)細胞百分比有輕微下降,并且高劑量組有一例受試者出現可能與研究藥物相關的1級中性粒細胞減少癥(最低值1.3 × 109/L),該受試者在后續隨訪中顯示部分恢復。
單細胞轉錄組學分析
對7名受試者(低、中劑量各2人,高劑量3人)的PBMCs進行scRNA-seq,共分析了122,956個高質量細胞,鑒定出T細胞、B細胞、NK細胞、前B細胞、單核細胞和造血干細胞(HSCs)等主要細胞類型。總體細胞比例在給藥前后未發生顯著變化,再次印證了其良好的安全性。
差異表達基因(DEG)分析顯示,在嚴格的統計標準下,整體細胞或特定細胞類型中均未發現大量顯著的基因表達變化,這表明ILB-202對健康個體的生理狀態影響甚微。然而,采用更寬松的標準進行分析后,基因本體(GO)和京都基因與基因組百科全書(KEGG)通路富集分析提示,NF-κB信號通路在多個細胞類型中均受到調節。
深入研究顯示,單核細胞是對ILB-202反應最敏感的細胞群體。根據CD14和CD16的表達,單核細胞可進一步分為經典(CD14highCD16low)和非經典(CD14lowCD16high)亞型。基因集富集分析(GSEA)揭示了這兩種亞型在NF-κB相關活性上存在顯著的功能差異。更重要的是,在低和中劑量下,與非經典單核細胞(通常與組織修復和炎癥消退相關)的比例在EOI和24h時間點呈現上升趨勢,這暗示了ILB-202可能促進了向抗炎狀態的轉變。
細胞間通訊分析(使用CellChat工具)進一步揭示了盡管轉錄水平變化細微,但細胞間的信號網絡發生了顯著的時間依賴性重塑。與給藥前相比,輸注后(EOI和24h)與抑制炎癥反應相關的信號通路變得更為突出。特別是,具有抗炎和免疫抑制特性的轉化生長因子-β(TGF-β)信號通路(TGFB1-TGFBR1/TGFBR2)的交互概率在EOI和24h均顯著增加。此外,內脂素(Visfatin, NAMPT)信號通路(NAMPT–INSR交互)在24h也變得顯著,該通路在調節NF-κB和炎癥過程中扮演多重角色。相反,關鍵的促炎信號——腫瘤壞死因子(TNF)信號通路(TNF-TNFRSF1A/B)的活性在后期時間點減弱。同時,一些趨化因子信號通路(如CCL和CXCL)也變得不顯著。這些變化共同描繪出一幅清晰的畫面:ILB-202給藥后,細胞間的通訊網絡整體向抗炎和炎癥消退的方向發展。
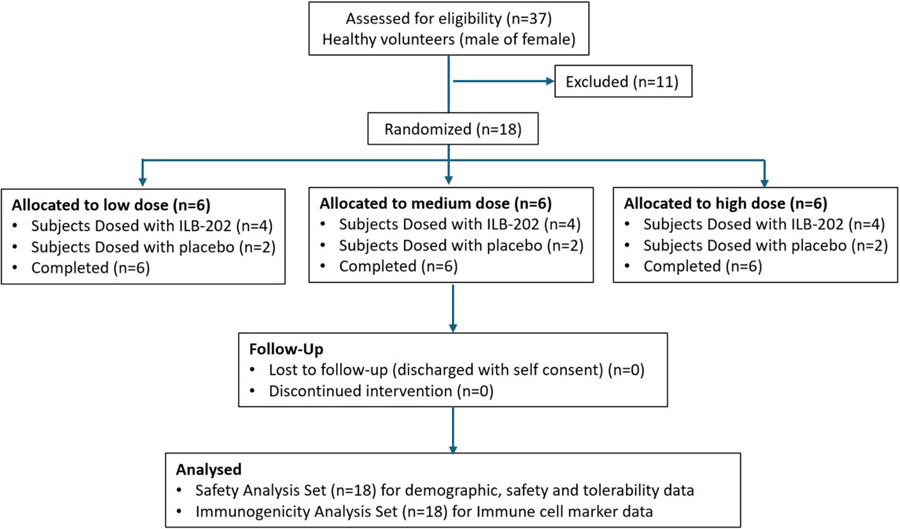
圖2 參與者招募與研究流程圖
討論與結論
本研究成功評估了ILB-202在健康人體中的首次系統性給藥。結果表明,單次靜脈輸注ILB-202在所有劑量水平下均安全且耐受性良好。更重要的是,先進的scRNA-seq技術揭示了其在分子和細胞水平上的精準藥效學作用:ILB-202能夠時間依賴性地調節NF-κB相關通路,增強TGF-β和Visfatin等抗炎信號,同時減弱TNF等促炎信號,從而在不引起廣泛免疫抑制或顯著基因表達擾動的前提下,巧妙地將免疫系統推向一個更具抗炎性的狀態。
這項研究具有里程碑式的意義,它是全球首項探討經靜脈全身給藥的、工程化的異體EV療法的臨床試驗。ILB-202所展示的“精準免疫調節”特性——即主要抑制病理性亢進的NF-κB活性,而非基礎生理活性——使其區別于傳統的小分子NF-κB抑制劑,有望克服后者導致的廣泛免疫抑制副作用。
綜上所述,這項I期臨床試驗的結果有力地支持了ILB-202作為一種新型、精準的免疫調節劑的巨大潛力,為其后續在由NF-κB過度激活驅動的各種炎癥性和自身免疫性疾病(如類風濕關節炎、炎癥性腸病、敗血癥等)中進行療效性研究奠定了堅實的基礎,標志著工程化EV療法向臨床轉化邁出了關鍵一步。
參考資料
[1] Safety and anti-inflammatory effects of ILB-202, an engineered extracellular vesicles for NF-κB inhibition: A double-blind, randomized, placebo-controlled phase 1 trial
摘要:本文報道了首項評估系統性給藥工程化細胞外囊泡(EV)ILB-202的I期臨床試驗。
核因子κB(NF-κB)的過度激活在多種炎癥性和自身免疫性疾病的發病機制中起著核心作用。然而,傳統的NF-κB抑制劑存在特異性差、導致廣泛免疫抑制等局限性。細胞外囊泡(Extracellular Vesicles, EVs)作為一種新興的治療性載體,具有天然的低復制風險、低腫瘤發生風險和良好的生物相容性優勢,為精準遞送治療性 cargo 提供了新途徑。ILB-202是一種經過工程化改造的異體EV,來源于HEK293細胞,并裝載了一種半衰期延長的、穩定的NF-κB抑制蛋白——超級抑制因子IκBα(super-repressor IκBα, srIκB)。其設計理念是在NF-κB病理性地高度激活的細胞中優先發揮抑制作用,而對健康細胞的正常生理功能影響極小。本研究旨在通過一項首次人體(First-in-human)試驗,評估單次靜脈注射遞增劑量ILB-202在健康志愿者中的短期安全性、耐受性及初步藥效學效應。

圖1 一種用于抑制NF-κB的工程化細胞外囊泡ILB-202的安全性與抗炎效果:雙盲、隨機、安慰劑對照的I期臨床試驗
研究方法
這是一項在澳大利亞單一研究中心進行的隨機、雙盲、安慰劑對照的I期劑量遞增研究(ILIAS研究ILB-202-001)。研究共設置了三個劑量組(Cohort 1-3),劑量水平分別為0.3、1.2和5.2 × 1010顆粒/千克(particles/kg),基于臨床前大鼠和犬的毒理學研究數據以及多種疾病模型(如急性腎損傷IRI模型、類風濕性關節炎、早產模型等)中的藥理活性劑量(PAD)確定。每個隊列隨機分配6名健康志愿者(4人接受ILB-202,2人接受安慰劑),共18人完成研究。ILB-202通過2小時靜脈輸注給藥。主要終點是評估安全性(不良事件、生命體征、實驗室檢查、心電圖等)和耐受性。關鍵的探索性終點包括通過流式細胞術分析免疫細胞亞群(CD4+、CD8+、CD19+、CD16/56+ NK細胞)的變化,以及利用單細胞RNA測序(scRNA-seq)對給藥前(Pre)、輸注結束時(EOI)和輸注后24小時(24h)采集的外周血單核細胞(PBMCs)進行轉錄組學分析,以深入探究ILB-202的分子機制和藥效學影響。
研究結果
安全性及耐受性
ILB-202在所有測試劑量下均表現出良好的安全性和耐受性。未發生死亡、嚴重不良事件(SAEs)或劑量限制性毒性(DLTs)。共報告了15例治療期出現的不良事件(TEAEs),發生在12名受試者中,絕大多數為1級(輕度)嚴重程度。唯一一例2級事件(輸注部位疼痛)發生在安慰劑組。實驗室參數、生命體征和細胞因子譜(IL-1β, IL-2, IL-6, IL-10, IFN-γ, TNF-α)及C反應蛋白(CRP)在24小時內保持穩定,未觀察到全身性免疫原性或細胞因子釋放綜合征(CRS)的跡象。值得注意的是,在中、高劑量組觀察到自然殺傷(NK)細胞百分比有輕微下降,并且高劑量組有一例受試者出現可能與研究藥物相關的1級中性粒細胞減少癥(最低值1.3 × 109/L),該受試者在后續隨訪中顯示部分恢復。
單細胞轉錄組學分析
對7名受試者(低、中劑量各2人,高劑量3人)的PBMCs進行scRNA-seq,共分析了122,956個高質量細胞,鑒定出T細胞、B細胞、NK細胞、前B細胞、單核細胞和造血干細胞(HSCs)等主要細胞類型。總體細胞比例在給藥前后未發生顯著變化,再次印證了其良好的安全性。
差異表達基因(DEG)分析顯示,在嚴格的統計標準下,整體細胞或特定細胞類型中均未發現大量顯著的基因表達變化,這表明ILB-202對健康個體的生理狀態影響甚微。然而,采用更寬松的標準進行分析后,基因本體(GO)和京都基因與基因組百科全書(KEGG)通路富集分析提示,NF-κB信號通路在多個細胞類型中均受到調節。
深入研究顯示,單核細胞是對ILB-202反應最敏感的細胞群體。根據CD14和CD16的表達,單核細胞可進一步分為經典(CD14highCD16low)和非經典(CD14lowCD16high)亞型。基因集富集分析(GSEA)揭示了這兩種亞型在NF-κB相關活性上存在顯著的功能差異。更重要的是,在低和中劑量下,與非經典單核細胞(通常與組織修復和炎癥消退相關)的比例在EOI和24h時間點呈現上升趨勢,這暗示了ILB-202可能促進了向抗炎狀態的轉變。
細胞間通訊分析(使用CellChat工具)進一步揭示了盡管轉錄水平變化細微,但細胞間的信號網絡發生了顯著的時間依賴性重塑。與給藥前相比,輸注后(EOI和24h)與抑制炎癥反應相關的信號通路變得更為突出。特別是,具有抗炎和免疫抑制特性的轉化生長因子-β(TGF-β)信號通路(TGFB1-TGFBR1/TGFBR2)的交互概率在EOI和24h均顯著增加。此外,內脂素(Visfatin, NAMPT)信號通路(NAMPT–INSR交互)在24h也變得顯著,該通路在調節NF-κB和炎癥過程中扮演多重角色。相反,關鍵的促炎信號——腫瘤壞死因子(TNF)信號通路(TNF-TNFRSF1A/B)的活性在后期時間點減弱。同時,一些趨化因子信號通路(如CCL和CXCL)也變得不顯著。這些變化共同描繪出一幅清晰的畫面:ILB-202給藥后,細胞間的通訊網絡整體向抗炎和炎癥消退的方向發展。

圖2 參與者招募與研究流程圖
討論與結論
本研究成功評估了ILB-202在健康人體中的首次系統性給藥。結果表明,單次靜脈輸注ILB-202在所有劑量水平下均安全且耐受性良好。更重要的是,先進的scRNA-seq技術揭示了其在分子和細胞水平上的精準藥效學作用:ILB-202能夠時間依賴性地調節NF-κB相關通路,增強TGF-β和Visfatin等抗炎信號,同時減弱TNF等促炎信號,從而在不引起廣泛免疫抑制或顯著基因表達擾動的前提下,巧妙地將免疫系統推向一個更具抗炎性的狀態。
這項研究具有里程碑式的意義,它是全球首項探討經靜脈全身給藥的、工程化的異體EV療法的臨床試驗。ILB-202所展示的“精準免疫調節”特性——即主要抑制病理性亢進的NF-κB活性,而非基礎生理活性——使其區別于傳統的小分子NF-κB抑制劑,有望克服后者導致的廣泛免疫抑制副作用。
綜上所述,這項I期臨床試驗的結果有力地支持了ILB-202作為一種新型、精準的免疫調節劑的巨大潛力,為其后續在由NF-κB過度激活驅動的各種炎癥性和自身免疫性疾病(如類風濕關節炎、炎癥性腸病、敗血癥等)中進行療效性研究奠定了堅實的基礎,標志著工程化EV療法向臨床轉化邁出了關鍵一步。
參考資料
[1] Safety and anti-inflammatory effects of ILB-202, an engineered extracellular vesicles for NF-κB inhibition: A double-blind, randomized, placebo-controlled phase 1 trial



