摘要:本文揭示了神經元活動在小細胞肺癌(SCLC)發病機制中的關鍵作用。
本文揭示了神經元活動在小細胞肺癌(SCLC)發病機制中的關鍵作用。研究表明,在腦內,谷氨酸能(glutamatergic)和GABA能(GABAergic)神經元通過旁分泌和突觸相互作用促進SCLC增殖;在肺內,迷走神經支配對原發性腫瘤發展至關重要。該發現為靶向神經-腫瘤互作提供了新的治療策略。
神經元活動依賴性機制在肺癌發病中的作用
神經系統作為腫瘤微環境的重要組成部分,在癌癥病理生物學中扮演著關鍵角色。近年來研究發現,神經元活動通過多種機制調控癌癥生長,特別是在腦部腫瘤中表現尤為顯著。小細胞肺癌(SCLC)作為一種致命的高級別神經內分泌腫瘤,具有強烈的腦轉移傾向,但其與神經系統的相互作用機制尚未完全闡明。

圖1 神經元活動依賴性的小細胞肺癌發病機制
迷走神經支配在肺原發腫瘤中的作用
研究首先探討了神經支配對SCLC在肺內生長的影響。通過對人類原發性SCLC樣本的分析,發現多個神經遞質受體基因的表達,表明SCLC細胞具備響應神經元信號的能力。利用Rb1fl/fl;Trp53fl/fl;p130fl/fl(RPR2)遺傳小鼠模型,研究人員觀察到肺內SCLC腫瘤受到多種神經纖維的支配,包括副交感神經(囊泡乙酰膽堿轉運蛋白標記)、交感神經(酪氨酸羥化酶蛋白標記)和感覺神經(髓鞘堿性蛋白標記亞群)。
通過單側頸迷走神經切斷術實驗,研究發現迷走神經切斷顯著抑制了原發性肺腫瘤的發展和進展。迷走神經切斷組小鼠的腫瘤負荷明顯減少,肝轉移的發生延遲,生存期顯著延長。值得注意的是,這種抑瘤效應主要在腫瘤發展早期階段顯著,在晚期疾病或MYC驅動的侵襲性SCLC模型中則不明顯,表明迷走神經支配對SCLC起始和早期發展至關重要。
腦內SCLC微環境中的神經元
考慮到SCLC的高腦轉移傾向,研究進一步探討了神經元與SCLC細胞在腦內的相互作用。對人類SCLC腦轉移樣本的分析顯示,腫瘤區域存在大量軸突與惡性細胞交織。靠近軸突(100μm以內)的SCLC細胞表現出更高的增殖率和核密度,提示神經元-SCLC相互作用可能具有功能意義。
由于缺乏可靠的自發性腦轉移模型,研究采用小鼠顱內同種異體移植模型,將SCLC細胞移植到特定腦區。這些腦內移植物表現出與人類樣本相似的神經元浸潤模式,特別是在腫瘤外周區域,神經元豐富區域的細胞增殖指數顯著高于神經元稀少區域。
神經元與SCLC在腦內的相互作用
通過共培養系統,研究發現活性神經元顯著增加了SCLC細胞的增殖率,這一效應可被電壓門控鈉通道阻斷劑河豚毒素(TTX)所抑制,表明其依賴于神經元動作電位。
單細胞RNA測序分析顯示,與神經元共培養的SCLC細胞呈現出獨特的轉錄表型。除了細胞增殖特征上調外,還發現了一個特定的細胞亞群(簇14),其突觸形成和神經遞質受體相關基因表達豐富,表現出突觸相關基因特征的富集。在TTX抑制神經元活動的情況下,這種突觸相關基因表達的富集消失,表明這是一種活動依賴性的惡性細胞可塑性機制。
對人類SCLC腦轉移組織的分析進一步證實了這一發現。與肺原發灶和其他轉移部位相比,腦內SCLC細胞顯著富集突觸相關基因特征。通過無偏聚類,研究人員發現腦轉移SCLC細胞可劃分為六個不同的元程序(metaprogramme),其中MP3程序以神經樣轉錄程序為特征,與神經和膠質前體樣特征相關。
SCLC在腦內的突觸整合
超微結構分析揭示了SCLC細胞與神經元之間形成直接突觸連接。免疫金標記明確地將惡性細胞定位在突觸后位置,證實這些癌細胞在結構上參與了神經元-SCLC突觸。盡管較少見,研究也發現了惡性細胞位于正常神經元-神經元突觸旁的"偽三方突觸"位置,與乳腺癌腦轉移中的描述類似。
電生理記錄進一步證實了SCLC細胞對神經元活動的功能響應。在電壓鉗制下,約22%的SCLC細胞表現出自發性興奮性突觸后電流(sEPSCs),這些電流可被AMPA受體阻斷劑NBQX抑制。神經元活動誘發的反應顯示,約55%的SCLC細胞表現出電流響應,這些響應可被TTX阻斷。
特別值得注意的是,GABA能突觸神經傳遞在SCLC中占主導地位,并且本質上具有去極化特性。穿孔膜片鉗記錄顯示,SCLC細胞中的GABA能突觸電流反轉電位為-27.3±5.5mV,而細胞貼附測量顯示SCLC基線靜息膜電位約為-72mV,表明GABA門控氯通道的開放導致SCLC去極化而非超極化。
神經遞質介導的信號在SCLC生長中的作用
研究利用誘導多能干細胞(iPS細胞)來源的神經元,建立了分離的谷氨酸能或GABA能神經元群體,與代表不同SCLC分子亞型的細胞系共培養。研究發現,谷氨酸能和GABA能神經元在不同SCLC亞型中均能引起增殖效應,不受轉錄表型影響。
通過添加TTX(廣譜神經元活動阻斷劑)或特異性神經遞質受體抑制劑MK801(NMDA受體抑制劑)、CNQX(AMPA/海人酸受體抑制劑)或gabazine(GABA受體抑制劑),研究人員證實了谷氨酸能和GABA能信號在SCLC對神經元活動的增殖反應中均發揮作用。
條件培養基實驗表明,神經元分泌的旁分泌因子可能貢獻但不完全解釋直接共培養的完整增殖效應,接觸介導的相互作用(如突觸通信)是神經元對SCLC細胞生長促進作用的重要組成部分。值得注意的是,已知的活動依賴性旁分泌因子neuroligin-3(NLGN3)和腦源性神經營養因子(BDNF)對SCLC細胞沒有促進增殖作用,這與它們在膠質瘤中的作用形成對比,突出了不同組織來源癌癥中活動依賴性機制的差異。
神經回路活動驅動顱內SCLC生長
通過體內光遺傳學技術,研究直接驗證了神經元活動對顱內SCLC腫瘤增殖的影響。在表達藍色光敏感通道通道視紫紅質(ChR2)的Thy1+深層皮質投射神經元中移植SCLC細胞,光遺傳學刺激皮層神經元活動后,SCLC細胞表現出增殖率的顯著增加。同時,SCLC細胞向正常腦實質的擴散也增加,更多細胞遷移出腫瘤邊緣。
考慮到GABA能突觸神經傳遞在電生理研究中的主導地位及其去極化性質,研究特別探討了GABA能中間神經元的貢獻。通過在小鼠皮層中移植SCLC細胞并結合腺相關病毒在Dlx表達的GABA能中間神經元中遺傳表達紅色光敏感通道視紫紅質ChRmine,光遺傳學刺激GABA能中間神經元活動促進了移植SCLC細胞的增殖,證實了GABA能神經元信號在顱內SCLC生長中的促瘤作用。
SCLC膜去極化調控生長
通過鈣成像技術,研究可視化SCLC細胞中神經遞質介導的電流。應用谷氨酸或GABA均能在表達GCaMP6s的SCLC細胞中引發明顯的鈣瞬變。原位雙光子鈣成像顯示,SCLC細胞中存在自發的和軸突刺激誘發的鈣瞬變,這些瞬變可被TTX阻斷,表明它們依賴于神經元活動。
基于突觸神經傳遞引起的SCLC膜去極化和 consequent 鈣瞬變,研究假設膜去極化本身為SCLC腫瘤在腦內提供功能優勢。通過光遺傳學直接去極化表達ChR2的SCLC細胞,研究發現膜去極化導致SCLC增殖指數增加,腫瘤總體大小約增加一倍,表明SCLC細胞在腦內利用神經元活動和 consequent 神經遞質介導的膜去極化來促進腫瘤進展。
互惠的神經元-SCLC相互作用
鑒于腦轉移癌常伴有癲癇發作,研究評估了SCLC細胞是否能夠 reciprocally 影響微環境中的神經元。通過量化共培養中突前 puncta(synapsin)與突后 puncta(HOMER1)的共定位,研究發現與SCLC細胞共培養的谷氨酸能神經元突觸數量顯著增加。
體內電子顯微圖像分析顯示,腫瘤區域的神經元-神經元突觸數量較對側非腫瘤對照組增加。多電極陣列(MEA)電生理學檢測發現,神經元在SCLC細胞存在下活動增加,表現為 spike 數量、振幅和頻率的增加。條件培養基實驗僅引起 spike 振幅的輕微增加,表明直接接觸對神經元超興奮性的重要性。
星形膠質細胞在神經元回路的形式和功能中具有核心作用,研究發現在SCLC細胞對神經元暴露的反應中,星形膠質細胞相關基因特征在特定細胞亞群(簇5)中表達增加,不與上調的突觸特征群體重疊。對人類SCLC腦轉移組織的分析顯示,腦內SCLC細胞中突觸發生促進性星形膠質細胞基因特征在特定元程序中上調,表明SCLC能夠在腦內重塑和加強神經元-SCLC相互作用。
靶向神經元-SCLC相互作用的治療策略
基于腫瘤區域神經元活動增加以及谷氨酸能和GABA能突觸信號驅動SCLC在腦內生長的發現,研究探索了利用現有臨床可用藥物靶向神經元-SCLC相互作用的治療潛力。通過使用常用抗癲癇藥物左乙拉西坦(levetiracetam,通過干擾突觸囊泡釋放起作用)減少活動依賴性信號,研究發現左乙拉西坦治療顯著降低了腦內SCLC細胞的增殖和腫瘤負荷,表明破壞神經元-SCLC相互作用將成為有效治療SCLC的核心組成部分。
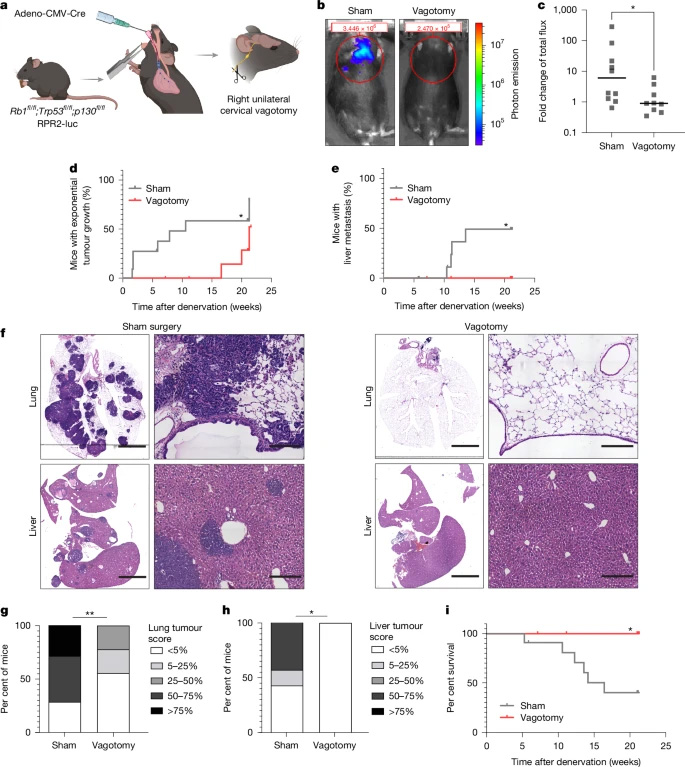
圖2 迷走神經的支配對于原發性小細胞肺癌的發生與發展至關重要
總結與展望
神經元活動對SCLC病理生理學的影響為癌癥中神經生物學的重要性提供了新的證據。這些發現表明,定植于腦內的SCLC細胞通過旁分泌和突觸機制利用神經元活動來增強生長和侵襲,同時 reciprocally 增加神經元興奮性和活動。未來研究需要進一步闡明介導這種活動驅動進展的特定分子信號級聯,可能揭示治療脆弱性。SCLC膜去極化的生長促進效應值得進一步研究電壓敏感性癌癥細胞增殖機制。迷走神經切斷對肺SCLC的顯著效應提出了關于迷走神經內不同軸突亞群的具體參與和相對貢獻的問題,這些問題的答案將提供潛在的治療靶點,如特異性神經遞質受體,并為將這些發現轉化為臨床應用提供信息。SCLC是一種治療選擇有限、預后差的疾病,因此,破壞神經元與SCLC在肺和腦中的功能相互作用代表了這種致命癌癥的有前景的治療策略。
參考資料
[1] Neuronal activity-dependent mechanisms of small cell lung cancer pathogenesis
摘要:本文揭示了神經元活動在小細胞肺癌(SCLC)發病機制中的關鍵作用。
本文揭示了神經元活動在小細胞肺癌(SCLC)發病機制中的關鍵作用。研究表明,在腦內,谷氨酸能(glutamatergic)和GABA能(GABAergic)神經元通過旁分泌和突觸相互作用促進SCLC增殖;在肺內,迷走神經支配對原發性腫瘤發展至關重要。該發現為靶向神經-腫瘤互作提供了新的治療策略。
神經元活動依賴性機制在肺癌發病中的作用
神經系統作為腫瘤微環境的重要組成部分,在癌癥病理生物學中扮演著關鍵角色。近年來研究發現,神經元活動通過多種機制調控癌癥生長,特別是在腦部腫瘤中表現尤為顯著。小細胞肺癌(SCLC)作為一種致命的高級別神經內分泌腫瘤,具有強烈的腦轉移傾向,但其與神經系統的相互作用機制尚未完全闡明。

圖1 神經元活動依賴性的小細胞肺癌發病機制
迷走神經支配在肺原發腫瘤中的作用
研究首先探討了神經支配對SCLC在肺內生長的影響。通過對人類原發性SCLC樣本的分析,發現多個神經遞質受體基因的表達,表明SCLC細胞具備響應神經元信號的能力。利用Rb1fl/fl;Trp53fl/fl;p130fl/fl(RPR2)遺傳小鼠模型,研究人員觀察到肺內SCLC腫瘤受到多種神經纖維的支配,包括副交感神經(囊泡乙酰膽堿轉運蛋白標記)、交感神經(酪氨酸羥化酶蛋白標記)和感覺神經(髓鞘堿性蛋白標記亞群)。
通過單側頸迷走神經切斷術實驗,研究發現迷走神經切斷顯著抑制了原發性肺腫瘤的發展和進展。迷走神經切斷組小鼠的腫瘤負荷明顯減少,肝轉移的發生延遲,生存期顯著延長。值得注意的是,這種抑瘤效應主要在腫瘤發展早期階段顯著,在晚期疾病或MYC驅動的侵襲性SCLC模型中則不明顯,表明迷走神經支配對SCLC起始和早期發展至關重要。
腦內SCLC微環境中的神經元
考慮到SCLC的高腦轉移傾向,研究進一步探討了神經元與SCLC細胞在腦內的相互作用。對人類SCLC腦轉移樣本的分析顯示,腫瘤區域存在大量軸突與惡性細胞交織。靠近軸突(100μm以內)的SCLC細胞表現出更高的增殖率和核密度,提示神經元-SCLC相互作用可能具有功能意義。
由于缺乏可靠的自發性腦轉移模型,研究采用小鼠顱內同種異體移植模型,將SCLC細胞移植到特定腦區。這些腦內移植物表現出與人類樣本相似的神經元浸潤模式,特別是在腫瘤外周區域,神經元豐富區域的細胞增殖指數顯著高于神經元稀少區域。
神經元與SCLC在腦內的相互作用
通過共培養系統,研究發現活性神經元顯著增加了SCLC細胞的增殖率,這一效應可被電壓門控鈉通道阻斷劑河豚毒素(TTX)所抑制,表明其依賴于神經元動作電位。
單細胞RNA測序分析顯示,與神經元共培養的SCLC細胞呈現出獨特的轉錄表型。除了細胞增殖特征上調外,還發現了一個特定的細胞亞群(簇14),其突觸形成和神經遞質受體相關基因表達豐富,表現出突觸相關基因特征的富集。在TTX抑制神經元活動的情況下,這種突觸相關基因表達的富集消失,表明這是一種活動依賴性的惡性細胞可塑性機制。
對人類SCLC腦轉移組織的分析進一步證實了這一發現。與肺原發灶和其他轉移部位相比,腦內SCLC細胞顯著富集突觸相關基因特征。通過無偏聚類,研究人員發現腦轉移SCLC細胞可劃分為六個不同的元程序(metaprogramme),其中MP3程序以神經樣轉錄程序為特征,與神經和膠質前體樣特征相關。
SCLC在腦內的突觸整合
超微結構分析揭示了SCLC細胞與神經元之間形成直接突觸連接。免疫金標記明確地將惡性細胞定位在突觸后位置,證實這些癌細胞在結構上參與了神經元-SCLC突觸。盡管較少見,研究也發現了惡性細胞位于正常神經元-神經元突觸旁的"偽三方突觸"位置,與乳腺癌腦轉移中的描述類似。
電生理記錄進一步證實了SCLC細胞對神經元活動的功能響應。在電壓鉗制下,約22%的SCLC細胞表現出自發性興奮性突觸后電流(sEPSCs),這些電流可被AMPA受體阻斷劑NBQX抑制。神經元活動誘發的反應顯示,約55%的SCLC細胞表現出電流響應,這些響應可被TTX阻斷。
特別值得注意的是,GABA能突觸神經傳遞在SCLC中占主導地位,并且本質上具有去極化特性。穿孔膜片鉗記錄顯示,SCLC細胞中的GABA能突觸電流反轉電位為-27.3±5.5mV,而細胞貼附測量顯示SCLC基線靜息膜電位約為-72mV,表明GABA門控氯通道的開放導致SCLC去極化而非超極化。
神經遞質介導的信號在SCLC生長中的作用
研究利用誘導多能干細胞(iPS細胞)來源的神經元,建立了分離的谷氨酸能或GABA能神經元群體,與代表不同SCLC分子亞型的細胞系共培養。研究發現,谷氨酸能和GABA能神經元在不同SCLC亞型中均能引起增殖效應,不受轉錄表型影響。
通過添加TTX(廣譜神經元活動阻斷劑)或特異性神經遞質受體抑制劑MK801(NMDA受體抑制劑)、CNQX(AMPA/海人酸受體抑制劑)或gabazine(GABA受體抑制劑),研究人員證實了谷氨酸能和GABA能信號在SCLC對神經元活動的增殖反應中均發揮作用。
條件培養基實驗表明,神經元分泌的旁分泌因子可能貢獻但不完全解釋直接共培養的完整增殖效應,接觸介導的相互作用(如突觸通信)是神經元對SCLC細胞生長促進作用的重要組成部分。值得注意的是,已知的活動依賴性旁分泌因子neuroligin-3(NLGN3)和腦源性神經營養因子(BDNF)對SCLC細胞沒有促進增殖作用,這與它們在膠質瘤中的作用形成對比,突出了不同組織來源癌癥中活動依賴性機制的差異。
神經回路活動驅動顱內SCLC生長
通過體內光遺傳學技術,研究直接驗證了神經元活動對顱內SCLC腫瘤增殖的影響。在表達藍色光敏感通道通道視紫紅質(ChR2)的Thy1+深層皮質投射神經元中移植SCLC細胞,光遺傳學刺激皮層神經元活動后,SCLC細胞表現出增殖率的顯著增加。同時,SCLC細胞向正常腦實質的擴散也增加,更多細胞遷移出腫瘤邊緣。
考慮到GABA能突觸神經傳遞在電生理研究中的主導地位及其去極化性質,研究特別探討了GABA能中間神經元的貢獻。通過在小鼠皮層中移植SCLC細胞并結合腺相關病毒在Dlx表達的GABA能中間神經元中遺傳表達紅色光敏感通道視紫紅質ChRmine,光遺傳學刺激GABA能中間神經元活動促進了移植SCLC細胞的增殖,證實了GABA能神經元信號在顱內SCLC生長中的促瘤作用。
SCLC膜去極化調控生長
通過鈣成像技術,研究可視化SCLC細胞中神經遞質介導的電流。應用谷氨酸或GABA均能在表達GCaMP6s的SCLC細胞中引發明顯的鈣瞬變。原位雙光子鈣成像顯示,SCLC細胞中存在自發的和軸突刺激誘發的鈣瞬變,這些瞬變可被TTX阻斷,表明它們依賴于神經元活動。
基于突觸神經傳遞引起的SCLC膜去極化和 consequent 鈣瞬變,研究假設膜去極化本身為SCLC腫瘤在腦內提供功能優勢。通過光遺傳學直接去極化表達ChR2的SCLC細胞,研究發現膜去極化導致SCLC增殖指數增加,腫瘤總體大小約增加一倍,表明SCLC細胞在腦內利用神經元活動和 consequent 神經遞質介導的膜去極化來促進腫瘤進展。
互惠的神經元-SCLC相互作用
鑒于腦轉移癌常伴有癲癇發作,研究評估了SCLC細胞是否能夠 reciprocally 影響微環境中的神經元。通過量化共培養中突前 puncta(synapsin)與突后 puncta(HOMER1)的共定位,研究發現與SCLC細胞共培養的谷氨酸能神經元突觸數量顯著增加。
體內電子顯微圖像分析顯示,腫瘤區域的神經元-神經元突觸數量較對側非腫瘤對照組增加。多電極陣列(MEA)電生理學檢測發現,神經元在SCLC細胞存在下活動增加,表現為 spike 數量、振幅和頻率的增加。條件培養基實驗僅引起 spike 振幅的輕微增加,表明直接接觸對神經元超興奮性的重要性。
星形膠質細胞在神經元回路的形式和功能中具有核心作用,研究發現在SCLC細胞對神經元暴露的反應中,星形膠質細胞相關基因特征在特定細胞亞群(簇5)中表達增加,不與上調的突觸特征群體重疊。對人類SCLC腦轉移組織的分析顯示,腦內SCLC細胞中突觸發生促進性星形膠質細胞基因特征在特定元程序中上調,表明SCLC能夠在腦內重塑和加強神經元-SCLC相互作用。
靶向神經元-SCLC相互作用的治療策略
基于腫瘤區域神經元活動增加以及谷氨酸能和GABA能突觸信號驅動SCLC在腦內生長的發現,研究探索了利用現有臨床可用藥物靶向神經元-SCLC相互作用的治療潛力。通過使用常用抗癲癇藥物左乙拉西坦(levetiracetam,通過干擾突觸囊泡釋放起作用)減少活動依賴性信號,研究發現左乙拉西坦治療顯著降低了腦內SCLC細胞的增殖和腫瘤負荷,表明破壞神經元-SCLC相互作用將成為有效治療SCLC的核心組成部分。

圖2 迷走神經的支配對于原發性小細胞肺癌的發生與發展至關重要
總結與展望
神經元活動對SCLC病理生理學的影響為癌癥中神經生物學的重要性提供了新的證據。這些發現表明,定植于腦內的SCLC細胞通過旁分泌和突觸機制利用神經元活動來增強生長和侵襲,同時 reciprocally 增加神經元興奮性和活動。未來研究需要進一步闡明介導這種活動驅動進展的特定分子信號級聯,可能揭示治療脆弱性。SCLC膜去極化的生長促進效應值得進一步研究電壓敏感性癌癥細胞增殖機制。迷走神經切斷對肺SCLC的顯著效應提出了關于迷走神經內不同軸突亞群的具體參與和相對貢獻的問題,這些問題的答案將提供潛在的治療靶點,如特異性神經遞質受體,并為將這些發現轉化為臨床應用提供信息。SCLC是一種治療選擇有限、預后差的疾病,因此,破壞神經元與SCLC在肺和腦中的功能相互作用代表了這種致命癌癥的有前景的治療策略。
參考資料
[1] Neuronal activity-dependent mechanisms of small cell lung cancer pathogenesis



