摘要:研究發現缺氧誘導的環狀RNA hsa_circ_0065394編碼新型蛋白cPFKFB4強化糖酵解并驅動腫瘤惡性進展。
胰腺癌作為消化系統高度惡性的腫瘤,其五年生存率始終徘徊在10%左右,被稱為"癌中之王"。這種嚴峻的預后與腫瘤特有的缺氧微環境密切相關。在胰腺癌組織中,氧分壓可低至0-5.3 mmHg,遠低于正常組織的9.3-92.7 mmHg。這種極度缺氧的狀態不僅幫助腫瘤細胞適應惡劣環境,還驅動了一系列惡性生物學行為,成為胰腺癌預后不良的獨立預測因素。
在缺氧微環境中,環狀RNA(circRNA)作為一類新型閉合環狀分子,通過反向剪接形成,其生物發生和功能與腫瘤缺氧微環境密切相關。研究表明,缺氧能誘導腫瘤細胞產生多種circRNA,這些分子幫助腫瘤細胞在缺氧條件下維持生存并促進腫瘤進展。然而,在胰腺癌中,缺氧相關circRNA編碼的蛋白質功能仍不清楚。
研究人員將目光聚焦于PFKFB4基因——一個在糖代謝中發揮關鍵作用的酶。PFKFB4作為糖酵解分流酶,在果糖-2,6-二磷酸和果糖-6-磷酸的相互轉化中起核心作用,滿足腫瘤細胞的能量需求和氧化還原穩態,從而促進腫瘤細胞在缺氧環境中的生存。基于此,研究團隊提出科學假設:源自PFKFB4基因的circRNA可能是驅動胰腺癌細胞適應缺氧微環境并持續惡性演進的關鍵分子。
為驗證這一假設,研究人員采用缺氧培養系統篩選胰腺癌中缺氧響應的circRNA,通過生物信息學分析和RNA免疫沉淀研究hsa_circ_0065394的環化機制,利用qRT-PCR和原位雜交評估其在胰腺癌中的表達譜和臨床意義。雙熒光素酶報告基因檢測、質譜分析和Western blotting鑒定出hsa_circ_0065394編碼的蛋白cPFKFB4。通過功能獲得和缺失實驗在體內外驗證cPFKFB4的生物學功能。從機制上,通過質譜分析、免疫共沉淀、免疫熒光、PKM剪接檢測、RNA免疫沉淀、Western blotting和挽救實驗,探索cPFKFB4如何調節hnRNP G與hnRNP A1的相互作用以及PKM選擇性剪接的調控。
研究發現缺氧相關的hsa_circ_0065394在胰腺癌組織中顯著上調,且與腫瘤大小密切相關。其生物環化由hnRNP L和Alu重復序列介導。機制上,hsa_circ_0065394通過非帽依賴機制編碼一個94個氨基酸的蛋白cPFKFB4。cPFKFB4通過特異性結合hnRNP G破壞hnRNP G-hnRNP A1復合物,促進hnRNP A1介導的PKM選擇性剪接,從而增加PKM2的表達,進而增強胰腺癌細胞的糖酵解,加速缺氧條件下胰腺癌的增殖和轉移。

圖1 由hsa_circ_0065394編碼的新型蛋白cPFKFB4通過增強PKM2介導的葡萄糖代謝重編程,促進胰腺癌在缺氧條件下的進展
關鍵技術方法
研究采用臨床樣本隊列(44對胰腺癌及癌旁組織)和腫瘤組織芯片(70例胰腺癌和58例正常組織),通過缺氧培養系統(1% O2)模擬腫瘤微環境。利用RNA酶R和放線菌素D實驗驗證circRNA特性,雙熒光素酶報告系統檢測IRES活性,質譜分析鑒定蛋白質相互作用,體內外功能實驗包括CCK-8、Transwell、裸鼠成瘤等評估生物學表型,PKM剪接實驗和代謝檢測分析分子機制。
hsa_circ_0065394在缺氧胰腺癌細胞中的鑒定與表征
研究人員首先在缺氧條件下篩選PFKFB4來源的circRNA,發現hsa_circ_0065394在缺氧胰腺癌細胞中表達最顯著。Sanger測序證實該circRNA是由PFKFB4基因外顯子2、3、4通過頭尾剪接形成的281nt環狀RNA。
實驗證實hsa_circ_0065394對RNA酶R具有抗性,且半衰期長于線性mRNA,在細胞核和細胞質中均有分布,表明其是缺氧胰腺癌細胞中豐富且穩定表達的circRNA。
hsa_circ_0065394的生物發生機制
通過生物信息學分析,研究人員在hsa_circ_0065394側翼內含子中發現了高反向互補性的Alu重復序列(AluYc和AluSx1)。缺失突變實驗證明只有同時存在這兩個Alu元件才能顯著上調hsa_circ_0065394表達。進一步篩選發現hnRNP L是hsa_circ_0065394生物發生的關鍵調控因子。RNA免疫沉淀實驗證實hnRNP L結合到PFKFB4前體mRNA的特定位點,促進側翼內含子互補重復元件的結合,從而加速hsa_circ_0065394的環化。
hsa_circ_0065394的表達特征與臨床意義
在胰腺癌細胞系中,hsa_circ_0065394表達顯著上調,尤其在PANC-1和PL45細胞中。臨床樣本分析顯示其在胰腺癌組織中明顯高表達,且與腫瘤大小顯著相關。
組織芯片和原位雜交結果進一步驗證了hsa_circ_0065394在胰腺癌組織中的高表達。生存分析顯示高表達患者總生存期更差,表明其具有重要的臨床預后價值。
hsa_circ_0065394編碼新型蛋白cPFKFB4
生物信息學預測發現hsa_circ_0065394包含一個285nt的開放閱讀框(ORF)和內部核糖體進入位點(IRES)。實驗證實該circRNA可翻譯產生約25kDa的蛋白,命名為cPFKFB4。
雙熒光素酶報告基因實驗證明IRES序列具有啟動翻譯活性,且完整的IRES序列對cPFKFB4的翻譯至關重要。
cPFKFB4通過hnRNP G調控PKM選擇性剪接
質譜分析和免疫共沉淀實驗發現cPFKFB4與hnRNP G特異性相互作用。進一步實驗確定cPFKFB4結合hnRNP G的SRGY和C-RBD結構域。
研究發現hnRNP G通過C-RBD結構域直接結合hnRNP A1,而cPFKFB4通過競爭性結合hnRNP G的C-RBD結構域,破壞hnRNP G-hnRNP A1復合物形成,從而增強hnRNP A1與PKM前體mRNA的結合。
PKM剪接實驗表明cPFKFB4上調增加PKM2亞型比例,下調增加PKM1亞型比例,且這一調控依賴于hnRNP G。
cPFKFB4增強胰腺癌細胞糖酵解
代謝檢測發現cPFKFB4顯著促進乳酸生成、葡萄糖攝取和ATP產生,增強胰腺癌細胞的糖酵解水平。挽救實驗證實這一效應通過hnRNP G介導。
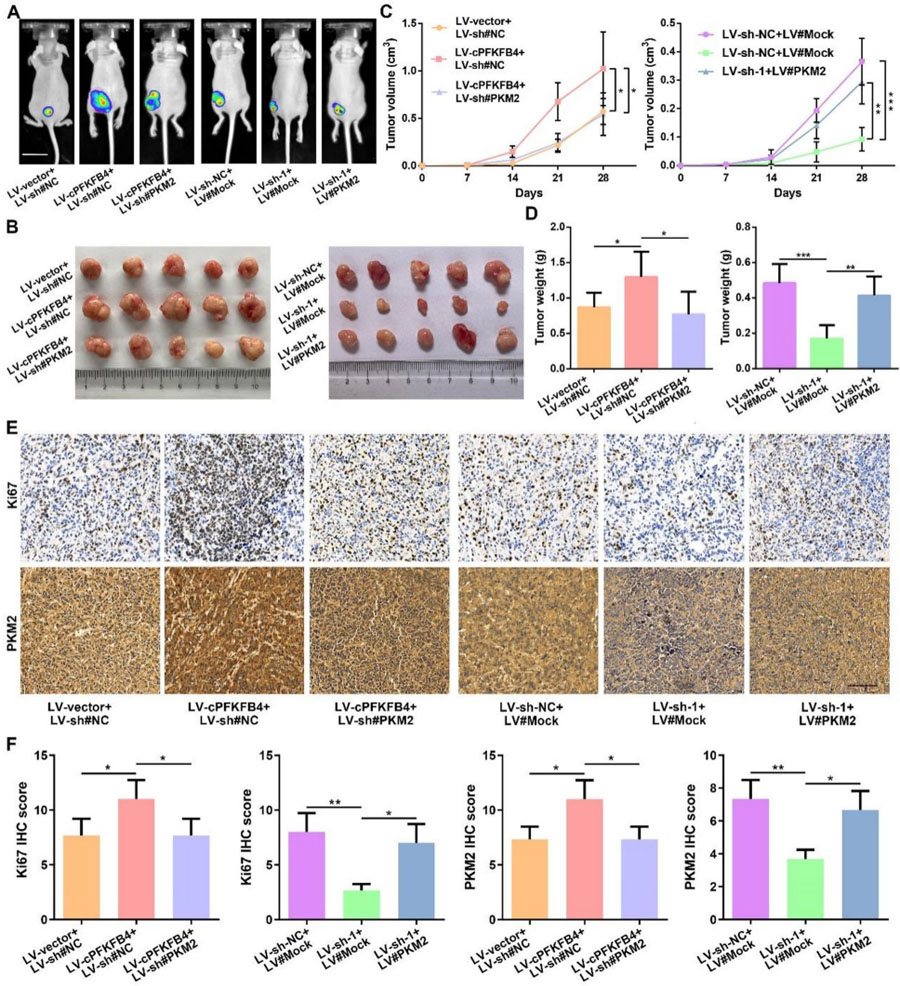
圖2 cPFKFB4通過PKM2促進胰腺癌惡性進展
cPFKFB4通過PKM2促進胰腺癌惡性進展
體內外實驗證實cPFKFB4通過PKM2促進胰腺癌細胞增殖、遷移和侵襲。動物實驗顯示cPFKFB4對腫瘤生長的促進作用可被PKM2敲低所逆轉。
研究結論與意義
該研究首次揭示了缺氧誘導的環狀RNA hsa_circ_0065394編碼新型蛋白cPFKFB4,通過調控hnRNP G/hnRNP A1復合物影響PKM選擇性剪接,進而重編程葡萄糖代謝促進胰腺癌進展的分子機制。
這一發現不僅為理解缺氧微環境、葡萄糖代謝重編程與胰腺癌惡性進展之間的交叉對話提供了新視角,也為胰腺癌的診斷和治療提供了潛在的生物標志物和治療靶點。cPFKFB4作為環狀RNA編碼的新型功能蛋白,拓展了我們對非編碼RNA功能多樣性的認識,為腫瘤代謝研究開辟了新方向。
該研究發表于《Molecular Cancer》雜志,為胰腺癌的精準治療提供了新的理論基礎和實驗依據,對改善胰腺癌患者預后具有重要的臨床意義。
參考資料
[1] A novel protein cPFKFB4 encoded by hsa_circ_0065394 strengthens PKM2-mediated glucose metabolic reprogramming to facilitate pancreatic cancer progression under hypoxia
摘要:研究發現缺氧誘導的環狀RNA hsa_circ_0065394編碼新型蛋白cPFKFB4強化糖酵解并驅動腫瘤惡性進展。
胰腺癌作為消化系統高度惡性的腫瘤,其五年生存率始終徘徊在10%左右,被稱為"癌中之王"。這種嚴峻的預后與腫瘤特有的缺氧微環境密切相關。在胰腺癌組織中,氧分壓可低至0-5.3 mmHg,遠低于正常組織的9.3-92.7 mmHg。這種極度缺氧的狀態不僅幫助腫瘤細胞適應惡劣環境,還驅動了一系列惡性生物學行為,成為胰腺癌預后不良的獨立預測因素。
在缺氧微環境中,環狀RNA(circRNA)作為一類新型閉合環狀分子,通過反向剪接形成,其生物發生和功能與腫瘤缺氧微環境密切相關。研究表明,缺氧能誘導腫瘤細胞產生多種circRNA,這些分子幫助腫瘤細胞在缺氧條件下維持生存并促進腫瘤進展。然而,在胰腺癌中,缺氧相關circRNA編碼的蛋白質功能仍不清楚。
研究人員將目光聚焦于PFKFB4基因——一個在糖代謝中發揮關鍵作用的酶。PFKFB4作為糖酵解分流酶,在果糖-2,6-二磷酸和果糖-6-磷酸的相互轉化中起核心作用,滿足腫瘤細胞的能量需求和氧化還原穩態,從而促進腫瘤細胞在缺氧環境中的生存。基于此,研究團隊提出科學假設:源自PFKFB4基因的circRNA可能是驅動胰腺癌細胞適應缺氧微環境并持續惡性演進的關鍵分子。
為驗證這一假設,研究人員采用缺氧培養系統篩選胰腺癌中缺氧響應的circRNA,通過生物信息學分析和RNA免疫沉淀研究hsa_circ_0065394的環化機制,利用qRT-PCR和原位雜交評估其在胰腺癌中的表達譜和臨床意義。雙熒光素酶報告基因檢測、質譜分析和Western blotting鑒定出hsa_circ_0065394編碼的蛋白cPFKFB4。通過功能獲得和缺失實驗在體內外驗證cPFKFB4的生物學功能。從機制上,通過質譜分析、免疫共沉淀、免疫熒光、PKM剪接檢測、RNA免疫沉淀、Western blotting和挽救實驗,探索cPFKFB4如何調節hnRNP G與hnRNP A1的相互作用以及PKM選擇性剪接的調控。
研究發現缺氧相關的hsa_circ_0065394在胰腺癌組織中顯著上調,且與腫瘤大小密切相關。其生物環化由hnRNP L和Alu重復序列介導。機制上,hsa_circ_0065394通過非帽依賴機制編碼一個94個氨基酸的蛋白cPFKFB4。cPFKFB4通過特異性結合hnRNP G破壞hnRNP G-hnRNP A1復合物,促進hnRNP A1介導的PKM選擇性剪接,從而增加PKM2的表達,進而增強胰腺癌細胞的糖酵解,加速缺氧條件下胰腺癌的增殖和轉移。

圖1 由hsa_circ_0065394編碼的新型蛋白cPFKFB4通過增強PKM2介導的葡萄糖代謝重編程,促進胰腺癌在缺氧條件下的進展
關鍵技術方法
研究采用臨床樣本隊列(44對胰腺癌及癌旁組織)和腫瘤組織芯片(70例胰腺癌和58例正常組織),通過缺氧培養系統(1% O2)模擬腫瘤微環境。利用RNA酶R和放線菌素D實驗驗證circRNA特性,雙熒光素酶報告系統檢測IRES活性,質譜分析鑒定蛋白質相互作用,體內外功能實驗包括CCK-8、Transwell、裸鼠成瘤等評估生物學表型,PKM剪接實驗和代謝檢測分析分子機制。
hsa_circ_0065394在缺氧胰腺癌細胞中的鑒定與表征
研究人員首先在缺氧條件下篩選PFKFB4來源的circRNA,發現hsa_circ_0065394在缺氧胰腺癌細胞中表達最顯著。Sanger測序證實該circRNA是由PFKFB4基因外顯子2、3、4通過頭尾剪接形成的281nt環狀RNA。
實驗證實hsa_circ_0065394對RNA酶R具有抗性,且半衰期長于線性mRNA,在細胞核和細胞質中均有分布,表明其是缺氧胰腺癌細胞中豐富且穩定表達的circRNA。
hsa_circ_0065394的生物發生機制
通過生物信息學分析,研究人員在hsa_circ_0065394側翼內含子中發現了高反向互補性的Alu重復序列(AluYc和AluSx1)。缺失突變實驗證明只有同時存在這兩個Alu元件才能顯著上調hsa_circ_0065394表達。進一步篩選發現hnRNP L是hsa_circ_0065394生物發生的關鍵調控因子。RNA免疫沉淀實驗證實hnRNP L結合到PFKFB4前體mRNA的特定位點,促進側翼內含子互補重復元件的結合,從而加速hsa_circ_0065394的環化。
hsa_circ_0065394的表達特征與臨床意義
在胰腺癌細胞系中,hsa_circ_0065394表達顯著上調,尤其在PANC-1和PL45細胞中。臨床樣本分析顯示其在胰腺癌組織中明顯高表達,且與腫瘤大小顯著相關。
組織芯片和原位雜交結果進一步驗證了hsa_circ_0065394在胰腺癌組織中的高表達。生存分析顯示高表達患者總生存期更差,表明其具有重要的臨床預后價值。
hsa_circ_0065394編碼新型蛋白cPFKFB4
生物信息學預測發現hsa_circ_0065394包含一個285nt的開放閱讀框(ORF)和內部核糖體進入位點(IRES)。實驗證實該circRNA可翻譯產生約25kDa的蛋白,命名為cPFKFB4。
雙熒光素酶報告基因實驗證明IRES序列具有啟動翻譯活性,且完整的IRES序列對cPFKFB4的翻譯至關重要。
cPFKFB4通過hnRNP G調控PKM選擇性剪接
質譜分析和免疫共沉淀實驗發現cPFKFB4與hnRNP G特異性相互作用。進一步實驗確定cPFKFB4結合hnRNP G的SRGY和C-RBD結構域。
研究發現hnRNP G通過C-RBD結構域直接結合hnRNP A1,而cPFKFB4通過競爭性結合hnRNP G的C-RBD結構域,破壞hnRNP G-hnRNP A1復合物形成,從而增強hnRNP A1與PKM前體mRNA的結合。
PKM剪接實驗表明cPFKFB4上調增加PKM2亞型比例,下調增加PKM1亞型比例,且這一調控依賴于hnRNP G。
cPFKFB4增強胰腺癌細胞糖酵解
代謝檢測發現cPFKFB4顯著促進乳酸生成、葡萄糖攝取和ATP產生,增強胰腺癌細胞的糖酵解水平。挽救實驗證實這一效應通過hnRNP G介導。

圖2 cPFKFB4通過PKM2促進胰腺癌惡性進展
cPFKFB4通過PKM2促進胰腺癌惡性進展
體內外實驗證實cPFKFB4通過PKM2促進胰腺癌細胞增殖、遷移和侵襲。動物實驗顯示cPFKFB4對腫瘤生長的促進作用可被PKM2敲低所逆轉。
研究結論與意義
該研究首次揭示了缺氧誘導的環狀RNA hsa_circ_0065394編碼新型蛋白cPFKFB4,通過調控hnRNP G/hnRNP A1復合物影響PKM選擇性剪接,進而重編程葡萄糖代謝促進胰腺癌進展的分子機制。
這一發現不僅為理解缺氧微環境、葡萄糖代謝重編程與胰腺癌惡性進展之間的交叉對話提供了新視角,也為胰腺癌的診斷和治療提供了潛在的生物標志物和治療靶點。cPFKFB4作為環狀RNA編碼的新型功能蛋白,拓展了我們對非編碼RNA功能多樣性的認識,為腫瘤代謝研究開辟了新方向。
該研究發表于《Molecular Cancer》雜志,為胰腺癌的精準治療提供了新的理論基礎和實驗依據,對改善胰腺癌患者預后具有重要的臨床意義。
參考資料
[1] A novel protein cPFKFB4 encoded by hsa_circ_0065394 strengthens PKM2-mediated glucose metabolic reprogramming to facilitate pancreatic cancer progression under hypoxia



