摘要:研究人員發現了一種此前未知的機制,解釋了細菌如何導致口腔癌和結直腸癌患者產生治療耐藥性。
人們已在多種癌癥中發現腫瘤內細菌,尤其是在黏膜部位,并將其視為腫瘤微環境的組成部分。然而,這些微生物如何影響微環境,目前仍不大清楚。
近日,Fred Hutchinson癌癥中心和MD Anderson癌癥中心的研究人員發現了一種此前未知的機制,解釋了細菌如何導致口腔癌和結直腸癌患者產生治療耐藥性。這項成果于10月16日發表在《Cancer Cell》雜志上。
研究發現,某些細菌,尤其是具核梭桿菌(Fn),會誘導癌癥上皮細胞進入一種可逆狀態,即靜息狀態。這使得腫瘤能夠逃避免疫系統的攻擊,并抵抗化療。
通訊作者、MD Anderson癌癥中心免疫學系副教授Susan Bullman博士表示:“這些細菌與腫瘤的相互作用一直隱藏在暗處。如今借助新技術,我們可以觀察到微生物如何直接影響癌細胞、塑造腫瘤行為并削弱治療效果。”

圖1 腫瘤浸潤細菌破壞癌細胞間上皮相互作用并誘導細胞周期阻滯
“這是我們一直忽視的腫瘤生物學層面,而現在我們開始著手研究它。我們希望這些發現能協助人們設計出針對微生物的療法,讓最棘手的癌癥也能輕松治愈。”
在這項研究中,研究人員發現胞外的梭桿菌進入腫瘤并包圍腫瘤上皮細胞,有效地切斷它們與周圍細胞的通訊,并使癌細胞暫時進入靜息狀態。這反過來又使它們能夠逃避免疫系統,抵抗化療并促進轉移。
空間成像與空間轉錄組學分析顯示,梭桿菌主要定位在結直腸癌和口腔癌的腫瘤微環境中,該區域以細胞密度降低、轉錄活性減弱及增殖減慢為特征。
體外實驗表明,具核梭桿菌可破壞上皮細胞連接,誘導G0-G1期阻滯和轉錄靜息狀態。這種狀態
重塑腫瘤微環境,并使得細胞對化療藥物氟尿嘧啶(5-fluorouracil)產生耐藥性。
研究人員在52例結直腸癌患者隊列中驗證了這些發現。在一個獨立的患者隊列中,高水平的梭桿菌與抗原呈遞基因下調和療效下降顯著相關。
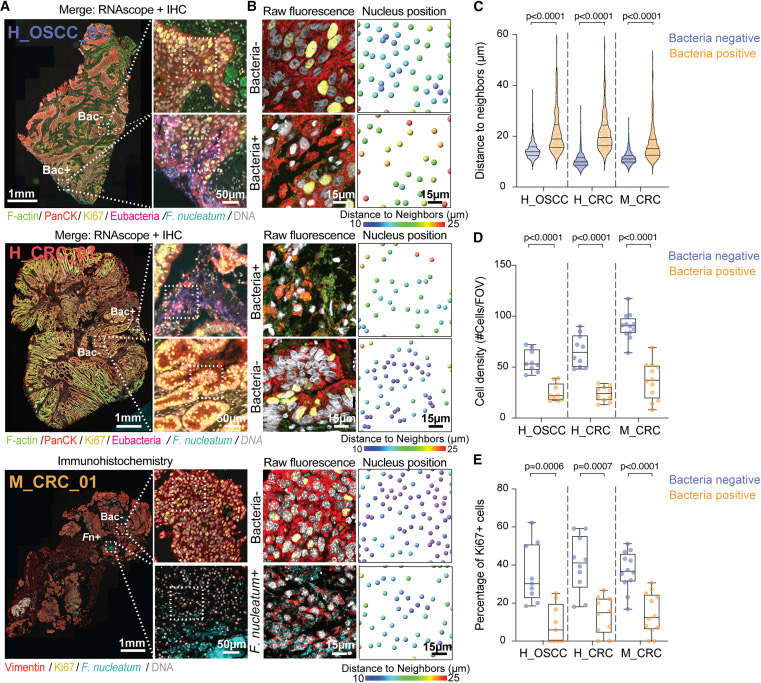
圖2 細菌感染微灶內癌細胞的空間分布
這些發現將胞外細菌與癌細胞靜息與化療耐藥相關聯,凸顯了以微生物-腫瘤相互作用為治療靶點的價值。
研究團隊也在探索如何將靶向腫瘤的細菌改造成未來的治療工具。這種“以菌為藥”的方法在癌癥治療中大有前景,因為實體瘤通常對傳統療法具有耐藥性。
不過,研究人員也承認,研究的局限性在于,實驗條件(包括實驗室細菌劑量和氧氣水平)可能無法完全模擬人類腫瘤內復雜而動態的環境。這凸顯了需要進一步研究以便更好地了解體內這些相互作用。
參考資料
[1] Tumor-infiltrating bacteria disrupt cancer epithelial cell interactions and induce cell-cycle arrest
摘要:研究人員發現了一種此前未知的機制,解釋了細菌如何導致口腔癌和結直腸癌患者產生治療耐藥性。
人們已在多種癌癥中發現腫瘤內細菌,尤其是在黏膜部位,并將其視為腫瘤微環境的組成部分。然而,這些微生物如何影響微環境,目前仍不大清楚。
近日,Fred Hutchinson癌癥中心和MD Anderson癌癥中心的研究人員發現了一種此前未知的機制,解釋了細菌如何導致口腔癌和結直腸癌患者產生治療耐藥性。這項成果于10月16日發表在《Cancer Cell》雜志上。
研究發現,某些細菌,尤其是具核梭桿菌(Fn),會誘導癌癥上皮細胞進入一種可逆狀態,即靜息狀態。這使得腫瘤能夠逃避免疫系統的攻擊,并抵抗化療。
通訊作者、MD Anderson癌癥中心免疫學系副教授Susan Bullman博士表示:“這些細菌與腫瘤的相互作用一直隱藏在暗處。如今借助新技術,我們可以觀察到微生物如何直接影響癌細胞、塑造腫瘤行為并削弱治療效果。”

圖1 腫瘤浸潤細菌破壞癌細胞間上皮相互作用并誘導細胞周期阻滯
“這是我們一直忽視的腫瘤生物學層面,而現在我們開始著手研究它。我們希望這些發現能協助人們設計出針對微生物的療法,讓最棘手的癌癥也能輕松治愈。”
在這項研究中,研究人員發現胞外的梭桿菌進入腫瘤并包圍腫瘤上皮細胞,有效地切斷它們與周圍細胞的通訊,并使癌細胞暫時進入靜息狀態。這反過來又使它們能夠逃避免疫系統,抵抗化療并促進轉移。
空間成像與空間轉錄組學分析顯示,梭桿菌主要定位在結直腸癌和口腔癌的腫瘤微環境中,該區域以細胞密度降低、轉錄活性減弱及增殖減慢為特征。
體外實驗表明,具核梭桿菌可破壞上皮細胞連接,誘導G0-G1期阻滯和轉錄靜息狀態。這種狀態重塑腫瘤微環境,并使得細胞對化療藥物氟尿嘧啶(5-fluorouracil)產生耐藥性。
研究人員在52例結直腸癌患者隊列中驗證了這些發現。在一個獨立的患者隊列中,高水平的梭桿菌與抗原呈遞基因下調和療效下降顯著相關。

圖2 細菌感染微灶內癌細胞的空間分布
這些發現將胞外細菌與癌細胞靜息與化療耐藥相關聯,凸顯了以微生物-腫瘤相互作用為治療靶點的價值。
研究團隊也在探索如何將靶向腫瘤的細菌改造成未來的治療工具。這種“以菌為藥”的方法在癌癥治療中大有前景,因為實體瘤通常對傳統療法具有耐藥性。
不過,研究人員也承認,研究的局限性在于,實驗條件(包括實驗室細菌劑量和氧氣水平)可能無法完全模擬人類腫瘤內復雜而動態的環境。這凸顯了需要進一步研究以便更好地了解體內這些相互作用。
參考資料
[1] Tumor-infiltrating bacteria disrupt cancer epithelial cell interactions and induce cell-cycle arrest



