摘要:本研究針對胰腺導管腺癌(PDAC)基質屏障致免疫治療耐藥難題,開發了靶向FN1的LQT肽修飾LDCP納米顆粒。
在多發性骨髓瘤(Multiple Myeloma, MM)的治療領域,自體造血干細胞移植(ASCT)一直是關鍵的治療手段,能夠顯著提高患者的緩解深度和無進展生存期。然而,臨床上仍面臨一個嚴峻挑戰:部分患者在移植后早期即出現復發,預后極差。目前,雖然國際分期系統(ISS)、高危細胞遺傳學異常(如del(17p)、t(4;14)等)和乳酸脫氫酶(LDH)水平等指標已被用于風險評估,但在移植時能有效預測早期復發的生物學標志物仍較為缺乏。
以往研究曾采用漿細胞標記指數(PCLI)評估漿細胞增殖活性,但由于其操作繁瑣、難以推廣,臨床應用受限。近年來,漿細胞增殖(PCPRO)檢測通過多參數流式細胞術定量骨髓中克隆性漿細胞處于S期的比例(S-phase%),為評估漿細胞增殖提供了一種更高效的方法。盡管已有研究證實診斷時S-phase%具有預后價值,但其在移植時的預測作用尚不明確。

圖1 自體干細胞移植時處于S期的殘余克隆性漿細胞對臨床結局的影響
為此,Tamer Hellou等研究人員開展了一項大樣本回顧性研究,旨在明確ASCT時S-phase%與患者生存結局之間的關系,并試圖識別那些可能無法從移植中獲益的高危人群,為臨床決策提供依據。該研究近期發表于《Blood Cancer Journal》。
本研究主要采用以下方法:首先,納入2013年1月至2024年8月在Mayo Clinic接受ASCT的1136例新診斷MM患者,根據移植時S-phase%分為<2%、≥2%和無法評估三組;其次,通過多參數流式細胞術(使用CD38、CD138、CD19、CD45、胞質輕鏈κ/λ及DAPI染色)鑒定克隆性漿細胞并計算S-phase%;最后,運用Kaplan-Meier曲線、Cox比例風險模型等統計方法比較各組間無進展生存(PFS)和總生存(OS),并校正年齡、ISS分期、肌酐、細胞遺傳學風險、緩解深度及維持治療等混雜因素。
患者特征與分組
最終納入的1136例患者中,372例S-phase<2%,142例≥2%,622例因克隆性漿細胞數量不足(<300個)無法評估。與S-phase<2%組相比,S-phase≥2%組患者高危細胞遺傳學異常(59.8% vs 31.9%)、ISS III期(31.6% vs 19.3%)和肌酐≥2 mg/dL(18.3% vs 8.6%)的比例均顯著更高(P<0.01),但兩組維持治療率無差異。< div="">
生存分析
中位隨訪41個月,S-phase≥2%組中位PFS為26個月,中位OS為57個月,均顯著差于S-phase<2%組(47個月和未達到)(p<0.0001)。多因素分析顯示,s-phase≥2%是pfs(hr=1.4)和os(hr=1.8)的獨立預測因子。無法評估s-phase的患者預后最佳,中位pfs達104個月,提示其代表生物學行為良好的群體。< div="">
圖1 自體干細胞移植時處于S期的殘余克隆性漿細胞對臨床結局的影響
S-phase%分層與極端高危人群
進一步將S-phase%分為<2%、2-4.9%、5-9.9%和≥10%四個亞組后,發現隨著s-phase%升高,生存結局急劇惡化。s-phase≥10%的患者中位pfs僅3.5個月,中位os僅9.5個月,提示這類患者幾乎無法從asct中獲益。< div="">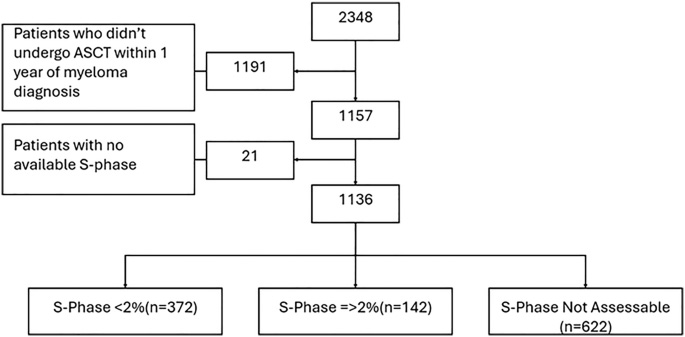
圖2 CONSORT流程圖:用于分析的患者選擇示意圖

圖2 CONSORT流程圖:用于分析的患者選擇示意圖
討論與意義
本研究首次在現代治療時代(含蛋白酶體抑制劑、免疫調節劑及CD38單抗誘導治療)背景下,證實ASCT時S-phase%是強效且獨立的預后標志物。尤其值得注意的是,S-phase≥5%(特別是≥10%)的患者屬于“功能性高危”群體,其預后極差,常規ASCT可能無法帶來臨床獲益。這一發現具有重要臨床意義:對于此類患者,應考慮避免移植,轉而探索CAR-T細胞療法、雙特異性抗體等新型免疫療法作為一線治療策略。
研究的優勢在于大樣本量和現代治療背景的代表性,而局限性包括回顧性設計和高S-phase%亞組樣本量較小。未來需前瞻性研究驗證S-phase%的預測價值,并優化高危患者的治療策略。
總之,該研究為MM的個體化治療提供了新思路:移植前S-phase%評估有望成為常規實踐,幫助識別那些需要替代治療策略的極端高危患者,最終改善臨床結局。
參考資料
[1] Stroma-Targeted Gene Delivery for Efficient Immunogene Therapy against Pancreatic Cancer
摘要:本研究針對胰腺導管腺癌(PDAC)基質屏障致免疫治療耐藥難題,開發了靶向FN1的LQT肽修飾LDCP納米顆粒。
在多發性骨髓瘤(Multiple Myeloma, MM)的治療領域,自體造血干細胞移植(ASCT)一直是關鍵的治療手段,能夠顯著提高患者的緩解深度和無進展生存期。然而,臨床上仍面臨一個嚴峻挑戰:部分患者在移植后早期即出現復發,預后極差。目前,雖然國際分期系統(ISS)、高危細胞遺傳學異常(如del(17p)、t(4;14)等)和乳酸脫氫酶(LDH)水平等指標已被用于風險評估,但在移植時能有效預測早期復發的生物學標志物仍較為缺乏。
以往研究曾采用漿細胞標記指數(PCLI)評估漿細胞增殖活性,但由于其操作繁瑣、難以推廣,臨床應用受限。近年來,漿細胞增殖(PCPRO)檢測通過多參數流式細胞術定量骨髓中克隆性漿細胞處于S期的比例(S-phase%),為評估漿細胞增殖提供了一種更高效的方法。盡管已有研究證實診斷時S-phase%具有預后價值,但其在移植時的預測作用尚不明確。

圖1 自體干細胞移植時處于S期的殘余克隆性漿細胞對臨床結局的影響
為此,Tamer Hellou等研究人員開展了一項大樣本回顧性研究,旨在明確ASCT時S-phase%與患者生存結局之間的關系,并試圖識別那些可能無法從移植中獲益的高危人群,為臨床決策提供依據。該研究近期發表于《Blood Cancer Journal》。
本研究主要采用以下方法:首先,納入2013年1月至2024年8月在Mayo Clinic接受ASCT的1136例新診斷MM患者,根據移植時S-phase%分為<2%、≥2%和無法評估三組;其次,通過多參數流式細胞術(使用CD38、CD138、CD19、CD45、胞質輕鏈κ/λ及DAPI染色)鑒定克隆性漿細胞并計算S-phase%;最后,運用Kaplan-Meier曲線、Cox比例風險模型等統計方法比較各組間無進展生存(PFS)和總生存(OS),并校正年齡、ISS分期、肌酐、細胞遺傳學風險、緩解深度及維持治療等混雜因素。
患者特征與分組
最終納入的1136例患者中,372例S-phase<2%,142例≥2%,622例因克隆性漿細胞數量不足(<300個)無法評估。與S-phase<2%組相比,S-phase≥2%組患者高危細胞遺傳學異常(59.8% vs 31.9%)、ISS III期(31.6% vs 19.3%)和肌酐≥2 mg/dL(18.3% vs 8.6%)的比例均顯著更高(P<0.01),但兩組維持治療率無差異。< div="">
生存分析
中位隨訪41個月,S-phase≥2%組中位PFS為26個月,中位OS為57個月,均顯著差于S-phase<2%組(47個月和未達到)(p<0.0001)。多因素分析顯示,s-phase≥2%是pfs(hr=1.4)和os(hr=1.8)的獨立預測因子。無法評估s-phase的患者預后最佳,中位pfs達104個月,提示其代表生物學行為良好的群體。< div="">
S-phase%分層與極端高危人群
進一步將S-phase%分為<2%、2-4.9%、5-9.9%和≥10%四個亞組后,發現隨著s-phase%升高,生存結局急劇惡化。s-phase≥10%的患者中位pfs僅3.5個月,中位os僅9.5個月,提示這類患者幾乎無法從asct中獲益。< div="">
圖2 CONSORT流程圖:用于分析的患者選擇示意圖

圖2 CONSORT流程圖:用于分析的患者選擇示意圖
討論與意義
本研究首次在現代治療時代(含蛋白酶體抑制劑、免疫調節劑及CD38單抗誘導治療)背景下,證實ASCT時S-phase%是強效且獨立的預后標志物。尤其值得注意的是,S-phase≥5%(特別是≥10%)的患者屬于“功能性高危”群體,其預后極差,常規ASCT可能無法帶來臨床獲益。這一發現具有重要臨床意義:對于此類患者,應考慮避免移植,轉而探索CAR-T細胞療法、雙特異性抗體等新型免疫療法作為一線治療策略。
研究的優勢在于大樣本量和現代治療背景的代表性,而局限性包括回顧性設計和高S-phase%亞組樣本量較小。未來需前瞻性研究驗證S-phase%的預測價值,并優化高危患者的治療策略。
總之,該研究為MM的個體化治療提供了新思路:移植前S-phase%評估有望成為常規實踐,幫助識別那些需要替代治療策略的極端高危患者,最終改善臨床結局。
參考資料
[1] Stroma-Targeted Gene Delivery for Efficient Immunogene Therapy against Pancreatic Cancer



