摘要:研究突破性發(fā)現(xiàn)組成型表達(dá)的COX-1(環(huán)氧化酶-1)在AD(阿爾茨海默病)微膠質(zhì)細(xì)胞激活中的核心作用。
阿爾茨海默病(AD)長(zhǎng)期以來被視為由β淀粉樣蛋白(Aβ)沉積和tau蛋白過度磷酸化主導(dǎo)的疾病,但近年研究發(fā)現(xiàn)神經(jīng)炎癥才是推動(dòng)疾病進(jìn)展的"隱形引擎"。其中,被稱為"管家酶"的環(huán)氧化酶-1(COX-1)在AD患者腦內(nèi)異常活躍,卻長(zhǎng)期被科學(xué)界忽視。這項(xiàng)發(fā)表在《Translational Neurodegeneration》的研究猶如打開潘多拉魔盒,首次揭示COX-1通過前列腺素E2(PGE2)信號(hào)通路點(diǎn)燃神經(jīng)炎癥風(fēng)暴的全新機(jī)制,為阻斷AD進(jìn)程提供了精準(zhǔn)靶點(diǎn)。
研究團(tuán)隊(duì)采用多組學(xué)聯(lián)合作戰(zhàn)策略:通過單細(xì)胞轉(zhuǎn)錄組分析ssREAD和ROSMAP隊(duì)列的人腦樣本鎖定COX-1的細(xì)胞定位;構(gòu)建COX-1基因敲除(KO)的5xFAD小鼠模型驗(yàn)證功能;結(jié)合空間轉(zhuǎn)錄組和蛋白質(zhì)印跡解析PGE2/EP2R-cAMP-PKA-NF-κB信號(hào)級(jí)聯(lián);最后通過Morris水迷宮等行為學(xué)測(cè)試評(píng)估認(rèn)知改善效果。

圖1 解除COX-1武裝以阻斷阿爾茨海默病炎癥進(jìn)程:臨床前研究見解與轉(zhuǎn)化潛力
COX-1在AD中的時(shí)空表達(dá)特征
單細(xì)胞測(cè)序顯示COX-1在AD患者和小鼠模型的微膠質(zhì)細(xì)胞中特異性上調(diào),且表達(dá)水平隨疾病進(jìn)展階梯式增長(zhǎng)。令人驚訝的是,這種變化在神經(jīng)元和星形膠質(zhì)細(xì)胞中幾乎檢測(cè)不到,暗示COX-1是微膠質(zhì)細(xì)胞炎癥反應(yīng)的專屬"開關(guān)"。
基因干預(yù)的全局效應(yīng)
COX-1 KO小鼠展現(xiàn)出三重保護(hù):海馬和皮層Aβ斑塊減少50%、NLRP3炎癥小體活性降低、空間記憶能力顯著改善。這證實(shí)抑制COX-1能同時(shí)打擊AD的病理標(biāo)志和功能損害,實(shí)現(xiàn)"一石三鳥"的治療效果。
信號(hào)通路的分子偵探
研究人員像拼圖般還原出完整信號(hào)鏈:COX-1催化產(chǎn)生的PGE2結(jié)合EP2受體后,通過cAMP-PKA通路激活NF-κB,進(jìn)而啟動(dòng)NLRP3炎癥小體的組裝。這一發(fā)現(xiàn)不僅解釋為何傳統(tǒng)COX-2抑制劑在AD臨床試驗(yàn)中折戟,更指明EP2R拮抗劑可能是更安全的替代方案。
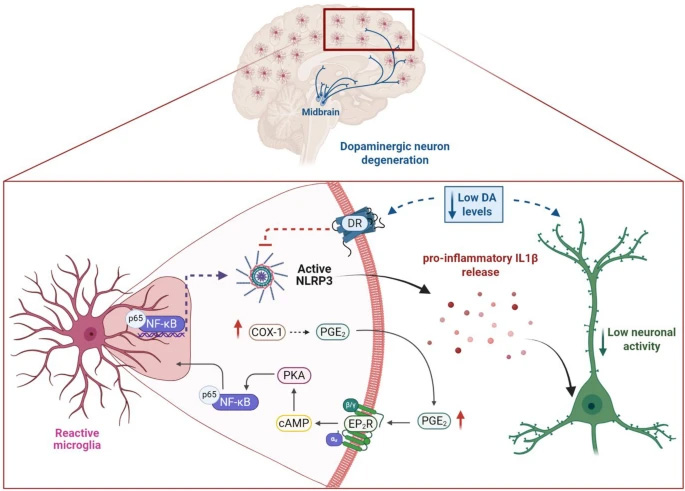
圖2 AD大腦中神經(jīng)炎癥信號(hào)傳導(dǎo)的示意圖
意料之外的神經(jīng)遞質(zhì)關(guān)聯(lián)
盡管未直接研究多巴胺(DA)系統(tǒng),但數(shù)據(jù)暗示COX-1與DA信號(hào)存在神秘交匯——兩者共享cAMP第二信使,且AD患者普遍存在DA能神經(jīng)元退化。這為理解為何AD患者常伴情緒障礙提供了新視角。
這項(xiàng)研究的意義猶如在AD治療領(lǐng)域投下"深水炸彈":首先,它顛覆了COX-1僅是生理性酶的傳統(tǒng)認(rèn)知,確立其作為病理性靶標(biāo)的地位;其次,闡明EP2R拮抗劑可規(guī)避傳統(tǒng)非甾體抗炎藥的出血風(fēng)險(xiǎn),為臨床轉(zhuǎn)化指明方向;最后,揭示的神經(jīng)炎癥-多巴胺系統(tǒng)交叉對(duì)話,為開發(fā)"一藥多靶"的聯(lián)合療法奠定基礎(chǔ)。正如研究者Gilda Loffredo和Marcello D'Amelio強(qiáng)調(diào)的,未來需聚焦兩個(gè)突破點(diǎn):開發(fā)能穿透血腦屏障的高選擇性COX-1抑制劑,以及在疾病更早期(如輕度認(rèn)知障礙階段)進(jìn)行干預(yù)。這項(xiàng)研究不僅為AD治療開辟新戰(zhàn)線,更可能重塑整個(gè)神經(jīng)退行性疾病的治療范式。
參考資料
[1] Disarming COX-1 to disrupt Alzheimer’s inflammatory trajectory: preclinical insights and translational promise
摘要:研究突破性發(fā)現(xiàn)組成型表達(dá)的COX-1(環(huán)氧化酶-1)在AD(阿爾茨海默病)微膠質(zhì)細(xì)胞激活中的核心作用。
阿爾茨海默病(AD)長(zhǎng)期以來被視為由β淀粉樣蛋白(Aβ)沉積和tau蛋白過度磷酸化主導(dǎo)的疾病,但近年研究發(fā)現(xiàn)神經(jīng)炎癥才是推動(dòng)疾病進(jìn)展的"隱形引擎"。其中,被稱為"管家酶"的環(huán)氧化酶-1(COX-1)在AD患者腦內(nèi)異常活躍,卻長(zhǎng)期被科學(xué)界忽視。這項(xiàng)發(fā)表在《Translational Neurodegeneration》的研究猶如打開潘多拉魔盒,首次揭示COX-1通過前列腺素E2(PGE2)信號(hào)通路點(diǎn)燃神經(jīng)炎癥風(fēng)暴的全新機(jī)制,為阻斷AD進(jìn)程提供了精準(zhǔn)靶點(diǎn)。
研究團(tuán)隊(duì)采用多組學(xué)聯(lián)合作戰(zhàn)策略:通過單細(xì)胞轉(zhuǎn)錄組分析ssREAD和ROSMAP隊(duì)列的人腦樣本鎖定COX-1的細(xì)胞定位;構(gòu)建COX-1基因敲除(KO)的5xFAD小鼠模型驗(yàn)證功能;結(jié)合空間轉(zhuǎn)錄組和蛋白質(zhì)印跡解析PGE2/EP2R-cAMP-PKA-NF-κB信號(hào)級(jí)聯(lián);最后通過Morris水迷宮等行為學(xué)測(cè)試評(píng)估認(rèn)知改善效果。

圖1 解除COX-1武裝以阻斷阿爾茨海默病炎癥進(jìn)程:臨床前研究見解與轉(zhuǎn)化潛力
COX-1在AD中的時(shí)空表達(dá)特征
單細(xì)胞測(cè)序顯示COX-1在AD患者和小鼠模型的微膠質(zhì)細(xì)胞中特異性上調(diào),且表達(dá)水平隨疾病進(jìn)展階梯式增長(zhǎng)。令人驚訝的是,這種變化在神經(jīng)元和星形膠質(zhì)細(xì)胞中幾乎檢測(cè)不到,暗示COX-1是微膠質(zhì)細(xì)胞炎癥反應(yīng)的專屬"開關(guān)"。
基因干預(yù)的全局效應(yīng)
COX-1 KO小鼠展現(xiàn)出三重保護(hù):海馬和皮層Aβ斑塊減少50%、NLRP3炎癥小體活性降低、空間記憶能力顯著改善。這證實(shí)抑制COX-1能同時(shí)打擊AD的病理標(biāo)志和功能損害,實(shí)現(xiàn)"一石三鳥"的治療效果。
信號(hào)通路的分子偵探
研究人員像拼圖般還原出完整信號(hào)鏈:COX-1催化產(chǎn)生的PGE2結(jié)合EP2受體后,通過cAMP-PKA通路激活NF-κB,進(jìn)而啟動(dòng)NLRP3炎癥小體的組裝。這一發(fā)現(xiàn)不僅解釋為何傳統(tǒng)COX-2抑制劑在AD臨床試驗(yàn)中折戟,更指明EP2R拮抗劑可能是更安全的替代方案。

圖2 AD大腦中神經(jīng)炎癥信號(hào)傳導(dǎo)的示意圖
意料之外的神經(jīng)遞質(zhì)關(guān)聯(lián)
盡管未直接研究多巴胺(DA)系統(tǒng),但數(shù)據(jù)暗示COX-1與DA信號(hào)存在神秘交匯——兩者共享cAMP第二信使,且AD患者普遍存在DA能神經(jīng)元退化。這為理解為何AD患者常伴情緒障礙提供了新視角。
這項(xiàng)研究的意義猶如在AD治療領(lǐng)域投下"深水炸彈":首先,它顛覆了COX-1僅是生理性酶的傳統(tǒng)認(rèn)知,確立其作為病理性靶標(biāo)的地位;其次,闡明EP2R拮抗劑可規(guī)避傳統(tǒng)非甾體抗炎藥的出血風(fēng)險(xiǎn),為臨床轉(zhuǎn)化指明方向;最后,揭示的神經(jīng)炎癥-多巴胺系統(tǒng)交叉對(duì)話,為開發(fā)"一藥多靶"的聯(lián)合療法奠定基礎(chǔ)。正如研究者Gilda Loffredo和Marcello D'Amelio強(qiáng)調(diào)的,未來需聚焦兩個(gè)突破點(diǎn):開發(fā)能穿透血腦屏障的高選擇性COX-1抑制劑,以及在疾病更早期(如輕度認(rèn)知障礙階段)進(jìn)行干預(yù)。這項(xiàng)研究不僅為AD治療開辟新戰(zhàn)線,更可能重塑整個(gè)神經(jīng)退行性疾病的治療范式。
參考資料
[1] Disarming COX-1 to disrupt Alzheimer’s inflammatory trajectory: preclinical insights and translational promise



