摘要:研究揭示了天然化合物巴伐查爾酮(Bava)作為首個(gè)靶向轉(zhuǎn)鐵蛋白受體(TFRC)的小分子抑制劑。
膀胱癌(BCa)是泌尿系統(tǒng)最常見的惡性腫瘤,其中吉西他濱(Gemcitabine)作為一線化療藥物常因耐藥導(dǎo)致治療失敗。耐藥機(jī)制與核糖核苷酸還原酶M1亞基(RRM1)過表達(dá)密切相關(guān),而鐵代謝通路(TFRC介導(dǎo)的Fe3+內(nèi)吞和線粒體鐵利用)在DNA修復(fù)中起關(guān)鍵作用。巴伐查爾酮(Bava)是一種天然查爾酮類化合物,前期研究顯示其具有廣譜抗腫瘤活性,但具體靶點(diǎn)和機(jī)制尚未闡明。

圖1 補(bǔ)骨脂查爾酮靶向轉(zhuǎn)鐵蛋白受體并增敏吉西他濱以調(diào)控膀胱癌進(jìn)展
藥物篩選與靶點(diǎn)鑒定
通過1657種中藥單體高通量篩選,發(fā)現(xiàn)Bava能顯著增強(qiáng)吉西他濱敏感性?;颊邅碓搭惼鞴伲≒DO)模型驗(yàn)證其協(xié)同效應(yīng)。化學(xué)蛋白質(zhì)組學(xué)結(jié)合分子對(duì)接顯示,Bava直接結(jié)合TFRC的416-460區(qū)域(競(jìng)爭(zhēng)性抑制轉(zhuǎn)鐵蛋白Tf結(jié)合)和EGFR的742-822結(jié)構(gòu)域,并通過DARTS和CETSA實(shí)驗(yàn)證實(shí)靶標(biāo)互作。
鐵代謝調(diào)控機(jī)制
Bava通過雙重作用阻斷鐵攝?。?)抑制Tf-TFRC內(nèi)吞,減少胞內(nèi)Fe2+水平;2)阻斷EGFR介導(dǎo)的TFRC-Y20磷酸化,穩(wěn)定膜定位TFRC。這導(dǎo)致線粒體Fe-S簇合成受阻,呼吸鏈復(fù)合體I-III活性下降,ATP生成減少。
DNA損傷修復(fù)抑制
RNA-seq分析發(fā)現(xiàn)Bava顯著下調(diào)ATR-CHEK1-E2F1通路。機(jī)制上,核內(nèi)Fe2+減少抑制ATR活化,阻斷E2F1對(duì)RRM1啟動(dòng)子(-904至-915 bp區(qū)域)的轉(zhuǎn)錄激活,從而降低RRM1表達(dá)。外源補(bǔ)充FeS可逆轉(zhuǎn)此效應(yīng),而鐵螯合劑DFO模擬Bava作用。
體內(nèi)外療效驗(yàn)證
原位膀胱癌模型顯示Bava單藥效果有限,但與吉西他濱聯(lián)用顯著抑制腫瘤生長(zhǎng)。PDX模型中,聯(lián)合治療組腫瘤體積減少60%以上。臨床樣本分析證實(shí)TFRC/RRM1高表達(dá)與晚期分期和不良預(yù)后相關(guān)。
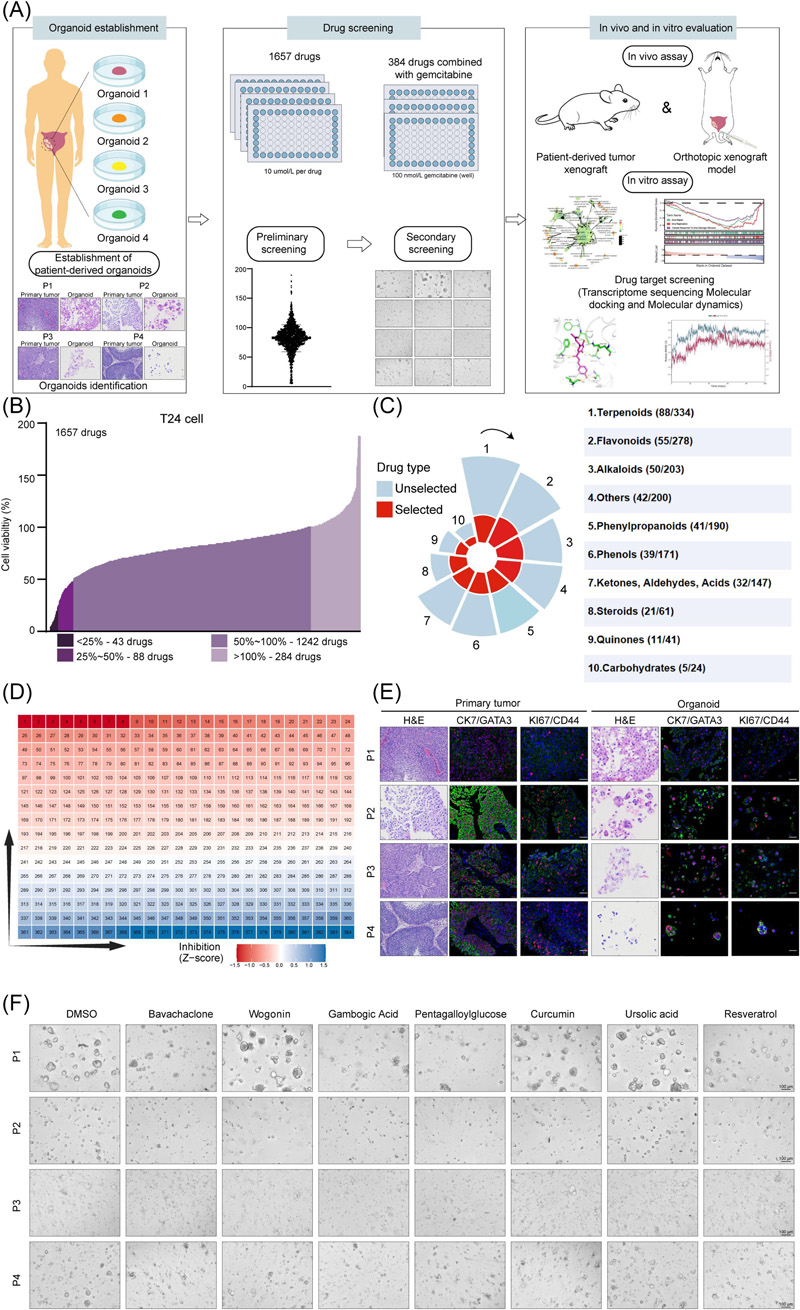
圖2 基于膀胱癌細(xì)胞和類器官的藥物篩選
本研究首次揭示Bava通過"鐵代謝- DNA修復(fù)"軸克服化療耐藥:靶向TFRC抑制鐵攝取,同時(shí)阻斷EGFR-TFRC磷酸化信號(hào),協(xié)同破壞線粒體功能和核內(nèi)DNA損傷修復(fù)。該發(fā)現(xiàn)為鐵代謝干預(yù)策略提供了新視角,TFRC/RRM1可作為BCa分層治療的生物標(biāo)志物。
研究采用CRISPR-Cas9構(gòu)建基因敲除細(xì)胞、ChIP-qPCR驗(yàn)證轉(zhuǎn)錄因子結(jié)合、Seahorse檢測(cè)線粒體呼吸功能,并通過IHC和TCGA數(shù)據(jù)分析臨床相關(guān)性。所有實(shí)驗(yàn)均通過復(fù)旦大學(xué)腫瘤醫(yī)院倫理審查(批準(zhǔn)號(hào)050432-4-2108)。
參考資料
[1] Bavachalcone targets transferrin receptor and sensitizes gemcitabine to affect bladder cancer progression
摘要:研究揭示了天然化合物巴伐查爾酮(Bava)作為首個(gè)靶向轉(zhuǎn)鐵蛋白受體(TFRC)的小分子抑制劑。
<div style="margin-top:12px;text-indent:24px中吉西他濱(Gemcitabine)作為一線化療藥物常因耐藥導(dǎo)致治療失敗。耐藥機(jī)制與核糖核苷酸還原酶M1亞基(RRM1)過表達(dá)密切相關(guān),而鐵代謝通路(TFRC介導(dǎo)的Fe3+內(nèi)吞和線粒體鐵利用)在DNA修復(fù)中起關(guān)鍵作用。巴伐查爾酮(Bava)是一種天然查爾酮類化合物,前期研究顯示其具有廣譜抗腫瘤活性,但具體靶點(diǎn)和機(jī)制尚未闡明。
圖1 補(bǔ)骨脂查爾酮靶向轉(zhuǎn)鐵蛋白受體并增敏吉西他濱以調(diào)控膀胱癌進(jìn)展
藥物篩選與靶點(diǎn)鑒定
通過1657種中藥單體高通量篩選,發(fā)現(xiàn)Bava能顯著增強(qiáng)吉西他濱敏感性?;颊邅碓搭惼鞴伲≒DO)模型驗(yàn)證其協(xié)同效應(yīng)?;瘜W(xué)蛋白質(zhì)組學(xué)結(jié)合分子對(duì)接顯示,Bava直接結(jié)合TFRC的416-460區(qū)域(競(jìng)爭(zhēng)性抑制轉(zhuǎn)鐵蛋白Tf結(jié)合)和EGFR的742-822結(jié)構(gòu)域,并通過DARTS和CETSA實(shí)驗(yàn)證實(shí)靶標(biāo)互作。
鐵代謝調(diào)控機(jī)制
Bava通過雙重作用阻斷鐵攝?。?)抑制Tf-TFRC內(nèi)吞,減少胞內(nèi)Fe2+水平;2)阻斷EGFR介導(dǎo)的TFRC-Y20磷酸化,穩(wěn)定膜定位TFRC。這導(dǎo)致線粒體Fe-S簇合成受阻,呼吸鏈復(fù)合體I-III活性下降,ATP生成減少。
DNA損傷修復(fù)抑制
RNA-seq分析發(fā)現(xiàn)Bava顯著下調(diào)ATR-CHEK1-E2F1通路。機(jī)制上,核內(nèi)Fe2+減少抑制ATR活化,阻斷E2F1對(duì)RRM1啟動(dòng)子(-904至-915 bp區(qū)域)的轉(zhuǎn)錄激活,從而降低RRM1表達(dá)。外源補(bǔ)充FeS可逆轉(zhuǎn)此效應(yīng),而鐵螯合劑DFO模擬Bava作用。
體內(nèi)外療效驗(yàn)證
原位膀胱癌模型顯示Bava單藥效果有限,但與吉西他濱聯(lián)用顯著抑制腫瘤生長(zhǎng)。PDX模型中,聯(lián)合治療組腫瘤體積減少60%以上。臨床樣本分析證實(shí)TFRC/RRM1高表達(dá)與晚期分期和不良預(yù)后相關(guān)。

圖2 基于膀胱癌細(xì)胞和類器官的藥物篩選
本研究首次揭示Bava通過"鐵代謝- DNA修復(fù)"軸克服化療耐藥:靶向TFRC抑制鐵攝取,同時(shí)阻斷EGFR-TFRC磷酸化信號(hào),協(xié)同破壞線粒體功能和核內(nèi)DNA損傷修復(fù)。該發(fā)現(xiàn)為鐵代謝干預(yù)策略提供了新視角,TFRC/RRM1可作為BCa分層治療的生物標(biāo)志物。
研究采用CRISPR-Cas9構(gòu)建基因敲除細(xì)胞、ChIP-qPCR驗(yàn)證轉(zhuǎn)錄因子結(jié)合、Seahorse檢測(cè)線粒體呼吸功能,并通過IHC和TCGA數(shù)據(jù)分析臨床相關(guān)性。所有實(shí)驗(yàn)均通過復(fù)旦大學(xué)腫瘤醫(yī)院倫理審查(批準(zhǔn)號(hào)050432-4-2108)。
參考資料
[1] Bavachalcone targets transferrin receptor and sensitizes gemcitabine to affect bladder cancer progression



