摘要:研究者發(fā)現(xiàn)circRNA BISC通過(guò)特異性靶向RNA結(jié)合蛋白IGF2BP2,抑制c-MYC mRNA翻譯從而逆轉(zhuǎn)耐藥
在腫瘤治療領(lǐng)域,BET蛋白家族作為識(shí)別乙酰化組蛋白的表觀遺傳"閱讀器",通過(guò)調(diào)控c-MYC等癌基因表達(dá)成為重要靶點(diǎn)。然而B(niǎo)ET抑制劑(BETi)在臨床應(yīng)用中面臨嚴(yán)峻挑戰(zhàn)——約50%實(shí)體瘤試驗(yàn)因快速出現(xiàn)的獲得性耐藥而終止。這種耐藥性在c-MYC高度依賴的三陰性乳腺癌(TNBC)中尤為突出,傳統(tǒng)策略如聯(lián)合用藥往往伴隨毒性增加,迫切需要揭示耐藥機(jī)制并開(kāi)發(fā)精準(zhǔn)干預(yù)手段。
針對(duì)這一關(guān)鍵科學(xué)問(wèn)題,研究人員通過(guò)系統(tǒng)分析發(fā)現(xiàn),耐藥TNBC細(xì)胞中circRNA BISC表達(dá)顯著降低,而RNA結(jié)合蛋白IGF2BP2異常激活。進(jìn)一步研究揭示,BISC含有獨(dú)特的"CAC-|9-12|-XGGX"基序,能特異性結(jié)合IGF2BP2的KH3/KH4結(jié)構(gòu)域,從而競(jìng)爭(zhēng)性阻斷IGF2BP2與c-MYC mRNA的相互作用。

圖1 環(huán)狀RNA適配體靶向IGF2BP2以克服獲得性BETi耐藥性
這種circRNA-RBP互作模式突破了傳統(tǒng)表觀遺傳藥物的作用框架,為克服耐藥性提供了新視角。
研究團(tuán)隊(duì)采用多組學(xué)聯(lián)用策略:首先通過(guò)全轉(zhuǎn)錄組測(cè)序鑒定耐藥相關(guān)circRNA表達(dá)譜;建立CRISPR-Cas13b高通量篩選平臺(tái)驗(yàn)證功能circRNA;結(jié)合RIP-seq(RNA免疫沉淀測(cè)序)分析IGF2BP2結(jié)合RNA動(dòng)態(tài)變化;運(yùn)用生物信息學(xué)預(yù)測(cè)RNA-蛋白互作基序;最后在PDX模型中評(píng)估體外轉(zhuǎn)錄環(huán)化BISC的治療效果。樣本來(lái)源于臨床耐藥TNBC患者源性異種移植模型。
主要研究發(fā)現(xiàn)包括:
耐藥機(jī)制解析:證實(shí)BETi長(zhǎng)期暴露導(dǎo)致BISC下調(diào),釋放的IGF2BP2增強(qiáng)c-MYC mRNA翻譯效率,獨(dú)立于β-catenin/GLI2/MED1轉(zhuǎn)錄調(diào)控通路。
分子互作驗(yàn)證:結(jié)構(gòu)生物學(xué)分析揭示BISC通過(guò)KH3/KH4結(jié)構(gòu)域選擇性抑制IGF2BP2,與同源蛋白IGF2BP1/3無(wú)交叉作用。
治療策略開(kāi)發(fā):靜脈注射的環(huán)化BISC在腫瘤組織特異性富集,與OTX015聯(lián)用顯著抑制耐藥TNBC生長(zhǎng),且通過(guò)肝腎快速清除降低系統(tǒng)毒性。
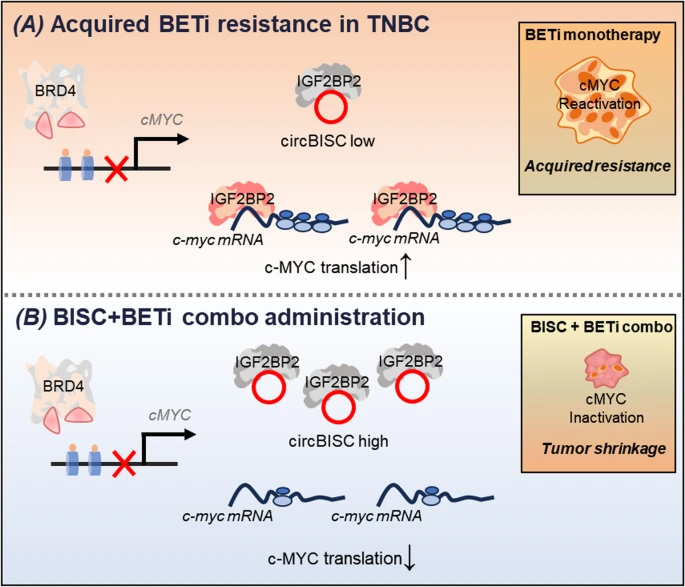
圖2 三陰性乳腺癌中獲得性BETi耐藥性的分子機(jī)制
這項(xiàng)研究的突破性意義體現(xiàn)在三個(gè)維度:科學(xué)層面,首次闡明circRNA通過(guò)翻譯調(diào)控參與表觀遺傳藥物耐藥的新機(jī)制;技術(shù)層面,建立"目標(biāo)導(dǎo)向"的circRNA篩選范式,突破傳統(tǒng)差異表達(dá)分析的局限性;臨床層面,開(kāi)發(fā)出具有明確作用靶點(diǎn)的circRNA療法,其模塊化設(shè)計(jì)可拓展至其他"不可成藥"RBP靶點(diǎn)。該成果為T(mén)NBC精準(zhǔn)治療提供新工具,同時(shí)為circRNA藥物的臨床轉(zhuǎn)化奠定重要基礎(chǔ)。
參考資料
[1] CircRNA aptamer targets IGF2BP2 to overcome acquired BETi resistance
摘要:研究者發(fā)現(xiàn)circRNA BISC通過(guò)特異性靶向RNA結(jié)合蛋白IGF2BP2,抑制c-MYC mRNA翻譯從而逆轉(zhuǎn)耐藥
在腫瘤治療領(lǐng)域,BET蛋白家族作為識(shí)別乙酰化組蛋白的表觀遺傳"閱讀器",通過(guò)調(diào)控c-MYC等癌基因表達(dá)成為重要靶點(diǎn)。然而B(niǎo)ET抑制劑(BETi)在臨床應(yīng)用中面臨嚴(yán)峻挑戰(zhàn)——約50%實(shí)體瘤試驗(yàn)因快速出現(xiàn)的獲得性耐藥而終止。這種耐藥性在c-MYC高度依賴的三陰性乳腺癌(TNBC)中尤為突出,傳統(tǒng)策略如聯(lián)合用藥往往伴隨毒性增加,迫切需要揭示耐藥機(jī)制并開(kāi)發(fā)精準(zhǔn)干預(yù)手段。
針對(duì)這一關(guān)鍵科學(xué)問(wèn)題,研究人員通過(guò)系統(tǒng)分析發(fā)現(xiàn),耐藥TNBC細(xì)胞中circRNA BISC表達(dá)顯著降低,而RNA結(jié)合蛋白IGF2BP2異常激活。進(jìn)一步研究揭示,BISC含有獨(dú)特的"CAC-|9-12|-XGGX"基序,能特異性結(jié)合IGF2BP2的KH3/KH4結(jié)構(gòu)域,從而競(jìng)爭(zhēng)性阻斷IGF2BP2與c-MYC mRNA的相互作用。

圖1 環(huán)狀RNA適配體靶向IGF2BP2以克服獲得性BETi耐藥性
這種circRNA-RBP互作模式突破了傳統(tǒng)表觀遺傳藥物的作用框架,為克服耐藥性提供了新視角。
研究團(tuán)隊(duì)采用多組學(xué)聯(lián)用策略:首先通過(guò)全轉(zhuǎn)錄組測(cè)序鑒定耐藥相關(guān)circRNA表達(dá)譜;建立CRISPR-Cas13b高通量篩選平臺(tái)驗(yàn)證功能circRNA;結(jié)合RIP-seq(RNA免疫沉淀測(cè)序)分析IGF2BP2結(jié)合RNA動(dòng)態(tài)變化;運(yùn)用生物信息學(xué)預(yù)測(cè)RNA-蛋白互作基序;最后在PDX模型中評(píng)估體外轉(zhuǎn)錄環(huán)化BISC的治療效果。樣本來(lái)源于臨床耐藥TNBC患者源性異種移植模型。
主要研究發(fā)現(xiàn)包括:
耐藥機(jī)制解析:證實(shí)BETi長(zhǎng)期暴露導(dǎo)致BISC下調(diào),釋放的IGF2BP2增強(qiáng)c-MYC mRNA翻譯效率,獨(dú)立于β-catenin/GLI2/MED1轉(zhuǎn)錄調(diào)控通路。
分子互作驗(yàn)證:結(jié)構(gòu)生物學(xué)分析揭示BISC通過(guò)KH3/KH4結(jié)構(gòu)域選擇性抑制IGF2BP2,與同源蛋白IGF2BP1/3無(wú)交叉作用。
治療策略開(kāi)發(fā):靜脈注射的環(huán)化BISC在腫瘤組織特異性富集,與OTX015聯(lián)用顯著抑制耐藥TNBC生長(zhǎng),且通過(guò)肝腎快速清除降低系統(tǒng)毒性。

圖2 三陰性乳腺癌中獲得性BETi耐藥性的分子機(jī)制
這項(xiàng)研究的突破性意義體現(xiàn)在三個(gè)維度:科學(xué)層面,首次闡明circRNA通過(guò)翻譯調(diào)控參與表觀遺傳藥物耐藥的新機(jī)制;技術(shù)層面,建立"目標(biāo)導(dǎo)向"的circRNA篩選范式,突破傳統(tǒng)差異表達(dá)分析的局限性;臨床層面,開(kāi)發(fā)出具有明確作用靶點(diǎn)的circRNA療法,其模塊化設(shè)計(jì)可拓展至其他"不可成藥"RBP靶點(diǎn)。該成果為T(mén)NBC精準(zhǔn)治療提供新工具,同時(shí)為circRNA藥物的臨床轉(zhuǎn)化奠定重要基礎(chǔ)。
參考資料
[1] CircRNA aptamer targets IGF2BP2 to overcome acquired BETi resistance



