摘要:首次揭示糖尿病前期微環境通過上調載脂蛋白CIII(apoCIII)表達誘發胰島炎癥反應和β細胞凋亡的分子機制。
在全球范圍內,1型糖尿病(T1D)發病率呈現令人擔憂的上升趨勢,且發病年齡不斷提前。這種自身免疫性疾病的核心特征是胰腺β細胞的進行性破壞,導致胰島素絕對缺乏。雖然胰島移植被視為潛在治療方案,但移植后的胰島存活率始終不理想——即使采用免疫抑制治療,移植到肝臟門靜脈系統的胰島仍難以長期存活,患者往往需要多次移植才能維持胰島素分泌功能。這一臨床困境引出了兩個關鍵科學問題:是否存在更優化的移植位點?能否通過生物工程手段增強胰島對免疫攻擊的抵抗力?
來自卡羅林斯卡醫學院(Karolinska Institutet)和西華醫院(West China Hospital)的聯合研究團隊在《Signal Transduction and Targeted Therapy》發表了一項突破性研究。研究人員創新性地利用BioBreeding(BB)大鼠模型,通過眼前房移植技術結合多模態成像,首次在活體水平揭示了糖尿病前期微環境對胰島功能的決定性影響。研究發現載脂蛋白CIII(apoCIII)作為關鍵介質,通過激活炎癥小體和促炎因子IL-1β,驅動了移植胰島的血管退化和β細胞凋亡。這一發現不僅闡明了T1D發病的微環境調控機制,更為開發抗炎性工程化胰島提供了明確靶點。

圖1 BioBreading大鼠模型中胰島環境與1型糖尿病發生
研究團隊采用了三項關鍵技術:1)糖尿病易感(DP)和抗性(DR)BB大鼠模型的建立與表征;2)眼前房移植技術實現胰島移植后的長期無創監測;3)激光共聚焦顯微成像定量分析胰島血管化和炎癥浸潤。通過交叉移植實驗設計(將DP大鼠胰島移植至DR大鼠眼前房,反之亦然),結合qRT-PCR、免疫熒光和體積定量分析等方法,系統評估了不同微環境對胰島功能的影響。
研究結果揭示:
1)微環境決定胰島命運:盡管移植初期所有胰島均能成功血管化,但處于糖尿病前期環境的DR胰島在T1D發病年齡附近出現功能性血管幾乎完全喪失,血管密度較基線下降顯著(p<0.05)。< div="">
圖1 BioBreading大鼠模型中胰島環境與1型糖尿病發生
2)apoCIII的核心作用:免疫染色顯示apoCIII在α和β細胞均有表達,且糖尿病前期胰島中apoCIII陽性細胞顯著增多(胰腺組織:DP 53.7±8.5% vs DR 75.5±3.4%;眼前房移植胰島:DP 33.6±4.2% vs DR 56.8±3.3%)。這種差異具有統計學意義(p<0.05)。< div="">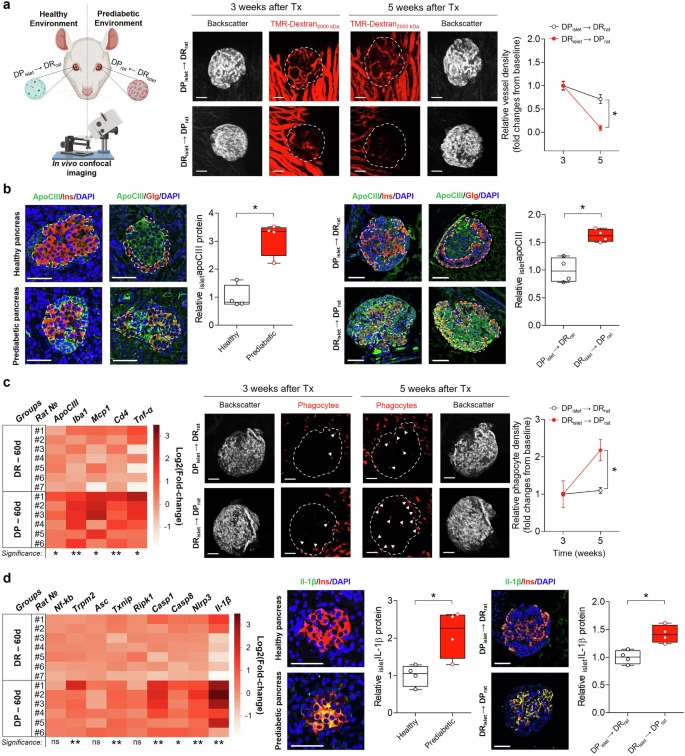
圖2 健康胰島移植至糖尿病前期環境及反向移植的效應
3)炎癥級聯反應:60日齡DP大鼠胰島顯示apoCIII上調伴隨炎癥標志物(Iba1、Mcp1、Cd4、Tnf-α)的顯著增加。炎癥小體相關基因的激活導致IL-1β水平升高,這一現象在移植至DP環境的DR胰島中同樣被觀察到。
4)臨床轉化價值:研究證實降低apoCIII表達可延緩T1D發病,提示其作為治療靶點的潛力。團隊計劃利用CRISPR/Cas9技術構建apoCIII低表達的人胰島類器官,以驗證其在糖尿病環境中的抵抗力。

圖2 健康胰島移植至糖尿病前期環境及反向移植的效應
這項研究的重要意義在于:首次在活體水平證實胰島微環境而非胰島自身特性決定移植結局;確立apoCIII-炎癥小體軸作為T1D進展的關鍵調控通路;提出眼前房作為潛在移植位點的臨床價值。研究由Patricia Recio-López、Per-Olof Berggren等學者完成,創新性地將基礎研究與臨床轉化相結合,為開發新一代抗炎性工程化胰島提供了理論依據和技術路線。特別值得注意的是,該團隊發現通過反義寡核苷酸降低apoCIII水平可延遲T1D發病,這一策略可能改寫當前胰島移植的治療范式。
參考資料
[1] Islet environment and development of type 1 diabetes in the biobreeding rat model
摘要:首次揭示糖尿病前期微環境通過上調載脂蛋白CIII(apoCIII)表達誘發胰島炎癥反應和β細胞凋亡的分子機制。
在全球范圍內,1型糖尿病(T1D)發病率呈現令人擔憂的上升趨勢,且發病年齡不斷提前。這種自身免疫性疾病的核心特征是胰腺β細胞的進行性破壞,導致胰島素絕對缺乏。雖然胰島移植被視為潛在治療方案,但移植后的胰島存活率始終不理想——即使采用免疫抑制治療,移植到肝臟門靜脈系統的胰島仍難以長期存活,患者往往需要多次移植才能維持胰島素分泌功能。這一臨床困境引出了兩個關鍵科學問題:是否存在更優化的移植位點?能否通過生物工程手段增強胰島對免疫攻擊的抵抗力?
來自卡羅林斯卡醫學院(Karolinska Institutet)和西華醫院(West China Hospital)的聯合研究團隊在《Signal Transduction and Targeted Therapy》發表了一項突破性研究。研究人員創新性地利用BioBreeding(BB)大鼠模型,通過眼前房移植技術結合多模態成像,首次在活體水平揭示了糖尿病前期微環境對胰島功能的決定性影響。研究發現載脂蛋白CIII(apoCIII)作為關鍵介質,通過激活炎癥小體和促炎因子IL-1β,驅動了移植胰島的血管退化和β細胞凋亡。這一發現不僅闡明了T1D發病的微環境調控機制,更為開發抗炎性工程化胰島提供了明確靶點。

圖1 BioBreading大鼠模型中胰島環境與1型糖尿病發生
研究團隊采用了三項關鍵技術:1)糖尿病易感(DP)和抗性(DR)BB大鼠模型的建立與表征;2)眼前房移植技術實現胰島移植后的長期無創監測;3)激光共聚焦顯微成像定量分析胰島血管化和炎癥浸潤。通過交叉移植實驗設計(將DP大鼠胰島移植至DR大鼠眼前房,反之亦然),結合qRT-PCR、免疫熒光和體積定量分析等方法,系統評估了不同微環境對胰島功能的影響。
研究結果揭示:
1)微環境決定胰島命運:盡管移植初期所有胰島均能成功血管化,但處于糖尿病前期環境的DR胰島在T1D發病年齡附近出現功能性血管幾乎完全喪失,血管密度較基線下降顯著(p<0.05)。< div="">
2)apoCIII的核心作用:免疫染色顯示apoCIII在α和β細胞均有表達,且糖尿病前期胰島中apoCIII陽性細胞顯著增多(胰腺組織:DP 53.7±8.5% vs DR 75.5±3.4%;眼前房移植胰島:DP 33.6±4.2% vs DR 56.8±3.3%)。這種差異具有統計學意義(p<0.05)。< div="">
圖2 健康胰島移植至糖尿病前期環境及反向移植的效應
3)炎癥級聯反應:60日齡DP大鼠胰島顯示apoCIII上調伴隨炎癥標志物(Iba1、Mcp1、Cd4、Tnf-α)的顯著增加。炎癥小體相關基因的激活導致IL-1β水平升高,這一現象在移植至DP環境的DR胰島中同樣被觀察到。
4)臨床轉化價值:研究證實降低apoCIII表達可延緩T1D發病,提示其作為治療靶點的潛力。團隊計劃利用CRISPR/Cas9技術構建apoCIII低表達的人胰島類器官,以驗證其在糖尿病環境中的抵抗力。

圖2 健康胰島移植至糖尿病前期環境及反向移植的效應
這項研究的重要意義在于:首次在活體水平證實胰島微環境而非胰島自身特性決定移植結局;確立apoCIII-炎癥小體軸作為T1D進展的關鍵調控通路;提出眼前房作為潛在移植位點的臨床價值。研究由Patricia Recio-López、Per-Olof Berggren等學者完成,創新性地將基礎研究與臨床轉化相結合,為開發新一代抗炎性工程化胰島提供了理論依據和技術路線。特別值得注意的是,該團隊發現通過反義寡核苷酸降低apoCIII水平可延遲T1D發病,這一策略可能改寫當前胰島移植的治療范式。
參考資料
[1] Islet environment and development of type 1 diabetes in the biobreeding rat model



