摘要: 本綜述深入探討了免疫代謝在腫瘤微環境(TME)中的關鍵作用。
免疫細胞代謝在調節細胞增殖、分化和功能反應中發揮著關鍵作用,共同塑造著腫瘤微環境(TME)內的免疫應答。 近期的研究進展日益凸顯了免疫細胞多樣化的代謝表型及其與腫瘤動態之間復雜的相互作用。免疫細胞代謝展現出顯著的可塑性,使得代謝網絡能夠根據外部刺激精確地調控免疫細胞的行為。此外,在免疫代謝學研究中,代謝特征與免疫細胞命運、活化狀態及功能之間的強關聯性已被反復闡明。因此,靶向被稱為“代謝檢查點”的代謝網絡,以重編程免疫細胞表型并增強抗腫瘤免疫力,為臨床轉化帶來了重大希望。本綜述總結了多層面代謝檢查點的最新研究進展,重點探討了代謝檢查點如何調控免疫學效應及癌癥進展。最后,文章探討了靶向代謝檢查點的潛在策略,以期為免疫治療領域啟發創新方法。
免疫代謝與腫瘤微環境的博弈
免疫細胞代謝在腫瘤微環境(TME)中扮演著決定性角色。不同于傳統觀點將代謝視為能量供應的被動過程,最新研究揭示代謝網絡主動調控著免疫細胞的增殖、分化和功能應答。這種代謝可塑性為癌癥免疫治療提供了全新靶點。

圖1 免疫細胞重塑中的代謝檢查點:重編程免疫代謝用于癌癥治療
代謝壓力下的腫瘤戰場
TME是一個營養匱乏、缺氧、酸性的惡劣環境。癌細胞通過Warburg效應大量消耗葡萄糖,產生乳酸堆積,同時競爭性攝取氨基酸如甲硫氨酸和精氨酸。這種代謝壓力直接抑制了CD8+ T細胞的mTOR活性和IFN-γ產生。有趣的是,乳酸雖能抑制常規DC細胞和NK細胞功能,卻意外地增強了CD8+ T細胞的干性特征。
T細胞的代謝交響曲
初始T細胞主要依賴氧化磷酸化(OXPHOS)維持靜息狀態,而激活后的效應T細胞則轉向有氧糖酵解以滿足快速增殖需求。這一轉換受mTORC1/2復合物調控,并通過MYC和HIF-1α上調GLUT1和HK2表達。值得注意的是,GLUT1在Th1、Th2和Th17細胞分化中不可或缺,但對Treg細胞卻非必需。
氨基酸代謝的暗戰
癌細胞通過高表達SLC43A2轉運體與T細胞競爭甲硫氨酸,降低組蛋白H3K4甲基化水平,從而抑制Th17細胞功能。精氨酸代謝同樣關鍵,腫瘤相關MDSC高表達精氨酸酶1(Arg1),消耗微環境中的精氨酸,導致T細胞CD3ζ鏈表達下降和功能衰竭。而靶向SLC7A11介導的胱氨酸代謝可防止CD8+ T細胞鐵死亡,增強抗腫瘤免疫。
脂質代謝的雙刃劍
CD36介導的氧化脂質攝取會誘發CD8+ T細胞鐵死亡和衰竭,但卻是Treg細胞維持免疫抑制功能所必需的。膽固醇代謝同樣具有兩面性:ACAT1缺失可增加T細胞膜膽固醇水平,增強免疫突觸形成;但過量膽固醇又會引發內質網應激,促進T細胞耗竭。
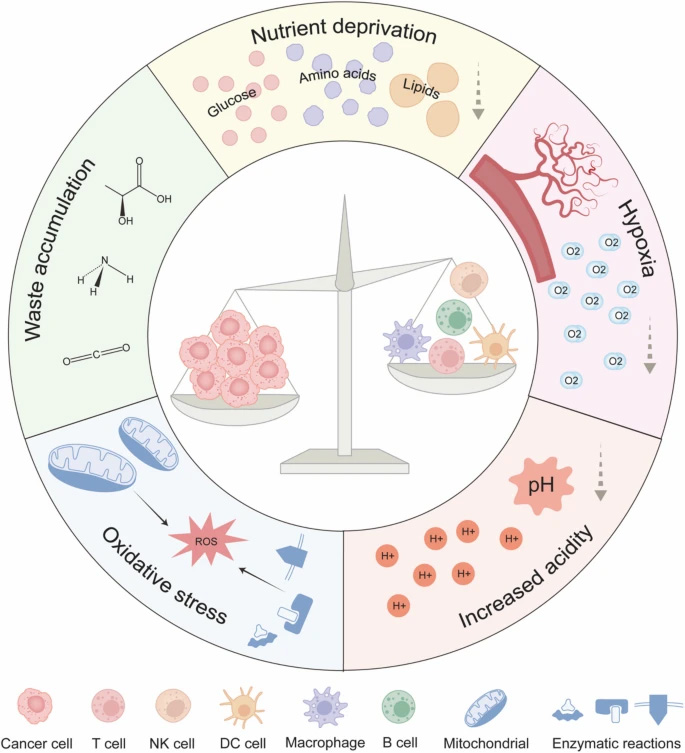
圖2 腫瘤微環境中的代謝壓力
代謝干預的治療曙光
臨床前研究展示了多種有前景的策略:JHU083通過抑制谷氨酰胺代謝同時增強T細胞OXPHOS;乳酸氧化酶納米膠囊降低TME酸度;精氨酸補充劑與化療聯用可重塑記憶T細胞代謝。值得注意的是,IDO/TDO雙重抑制劑較單藥顯示出更好的協同效應,而CRISPR技術敲除LDHA可改善TME免疫狀態。
未來挑戰與展望
盡管前景廣闊,代謝治療仍面臨重大挑戰:不同免疫細胞代謝網絡相互交織;代謝物如乳酸的雙向作用;以及如何實現時空特異性干預。整合單細胞代謝組學、微生物組調控等新技術將有助于突破當前局限,開創癌癥免疫治療新紀元。
參考資料
[1] Metabolic checkpoints in immune cell reprogramming: rewiring immunometabolism for cancer therapy
摘要: 本綜述深入探討了免疫代謝在腫瘤微環境(TME)中的關鍵作用。
免疫細胞代謝在調節細胞增殖、分化和功能反應中發揮著關鍵作用,共同塑造著腫瘤微環境(TME)內的免疫應答。 近期的研究進展日益凸顯了免疫細胞多樣化的代謝表型及其與腫瘤動態之間復雜的相互作用。免疫細胞代謝展現出顯著的可塑性,使得代謝網絡能夠根據外部刺激精確地調控免疫細胞的行為。此外,在免疫代謝學研究中,代謝特征與免疫細胞命運、活化狀態及功能之間的強關聯性已被反復闡明。因此,靶向被稱為“代謝檢查點”的代謝網絡,以重編程免疫細胞表型并增強抗腫瘤免疫力,為臨床轉化帶來了重大希望。本綜述總結了多層面代謝檢查點的最新研究進展,重點探討了代謝檢查點如何調控免疫學效應及癌癥進展。最后,文章探討了靶向代謝檢查點的潛在策略,以期為免疫治療領域啟發創新方法。
免疫代謝與腫瘤微環境的博弈
免疫細胞代謝在腫瘤微環境(TME)中扮演著決定性角色。不同于傳統觀點將代謝視為能量供應的被動過程,最新研究揭示代謝網絡主動調控著免疫細胞的增殖、分化和功能應答。這種代謝可塑性為癌癥免疫治療提供了全新靶點。

圖1 免疫細胞重塑中的代謝檢查點:重編程免疫代謝用于癌癥治療
代謝壓力下的腫瘤戰場
TME是一個營養匱乏、缺氧、酸性的惡劣環境。癌細胞通過Warburg效應大量消耗葡萄糖,產生乳酸堆積,同時競爭性攝取氨基酸如甲硫氨酸和精氨酸。這種代謝壓力直接抑制了CD8+ T細胞的mTOR活性和IFN-γ產生。有趣的是,乳酸雖能抑制常規DC細胞和NK細胞功能,卻意外地增強了CD8+ T細胞的干性特征。
T細胞的代謝交響曲
初始T細胞主要依賴氧化磷酸化(OXPHOS)維持靜息狀態,而激活后的效應T細胞則轉向有氧糖酵解以滿足快速增殖需求。這一轉換受mTORC1/2復合物調控,并通過MYC和HIF-1α上調GLUT1和HK2表達。值得注意的是,GLUT1在Th1、Th2和Th17細胞分化中不可或缺,但對Treg細胞卻非必需。
氨基酸代謝的暗戰
癌細胞通過高表達SLC43A2轉運體與T細胞競爭甲硫氨酸,降低組蛋白H3K4甲基化水平,從而抑制Th17細胞功能。精氨酸代謝同樣關鍵,腫瘤相關MDSC高表達精氨酸酶1(Arg1),消耗微環境中的精氨酸,導致T細胞CD3ζ鏈表達下降和功能衰竭。而靶向SLC7A11介導的胱氨酸代謝可防止CD8+ T細胞鐵死亡,增強抗腫瘤免疫。
脂質代謝的雙刃劍
CD36介導的氧化脂質攝取會誘發CD8+ T細胞鐵死亡和衰竭,但卻是Treg細胞維持免疫抑制功能所必需的。膽固醇代謝同樣具有兩面性:ACAT1缺失可增加T細胞膜膽固醇水平,增強免疫突觸形成;但過量膽固醇又會引發內質網應激,促進T細胞耗竭。

圖2 腫瘤微環境中的代謝壓力
代謝干預的治療曙光
臨床前研究展示了多種有前景的策略:JHU083通過抑制谷氨酰胺代謝同時增強T細胞OXPHOS;乳酸氧化酶納米膠囊降低TME酸度;精氨酸補充劑與化療聯用可重塑記憶T細胞代謝。值得注意的是,IDO/TDO雙重抑制劑較單藥顯示出更好的協同效應,而CRISPR技術敲除LDHA可改善TME免疫狀態。
未來挑戰與展望
盡管前景廣闊,代謝治療仍面臨重大挑戰:不同免疫細胞代謝網絡相互交織;代謝物如乳酸的雙向作用;以及如何實現時空特異性干預。整合單細胞代謝組學、微生物組調控等新技術將有助于突破當前局限,開創癌癥免疫治療新紀元。
參考資料
[1] Metabolic checkpoints in immune cell reprogramming: rewiring immunometabolism for cancer therapy



