摘要:免疫系統(tǒng)在檢測(cè)和摧毀癌細(xì)胞方面起著關(guān)鍵作用。
免疫系統(tǒng)在檢測(cè)和摧毀癌細(xì)胞方面起著關(guān)鍵作用。癌癥免疫療法通過(guò)編程免疫細(xì)胞來(lái)識(shí)別和消除癌細(xì)胞。然而,許多癌癥可以通過(guò)各種機(jī)制逃避免疫監(jiān)視,導(dǎo)致對(duì)治療的抵抗。這突顯了需要更好地了解使免疫逃避成為可能的分子過(guò)程。
腫瘤微環(huán)境(TME)——腫瘤周圍的空間——在癌癥和免疫細(xì)胞之間的相互作用中起著關(guān)鍵作用。癌細(xì)胞可以重塑TME,使其發(fā)揮優(yōu)勢(shì),削弱腫瘤浸潤(rùn)淋巴細(xì)胞(TILs),即攻擊腫瘤的免疫細(xì)胞。線粒體,也被稱為“細(xì)胞的發(fā)電站”,是為各種細(xì)胞過(guò)程產(chǎn)生能量的小細(xì)胞器。它們?cè)诎┘?xì)胞和TILs的代謝重編程中起著重要作用。然而,線粒體功能障礙的確切機(jī)制及其對(duì)TME的影響尚不清楚。
 圖1 腫瘤微環(huán)境中線粒體轉(zhuǎn)移的免疫逃逸
圖1 腫瘤微環(huán)境中線粒體轉(zhuǎn)移的免疫逃逸為了解決這一知識(shí)缺口,日本岡山大學(xué)的Yosuke Togashi教授領(lǐng)導(dǎo)的研究團(tuán)隊(duì)發(fā)現(xiàn)了癌癥免疫逃避中線粒體功能障礙的新見(jiàn)解。與來(lái)自岡山大學(xué)的Noriaki Nishida和Tomofumi Watanabe,以及來(lái)自千葉癌癥中心研究所的Hideki Ikeda、Katsushige Ono和Masayuki Okuno合作,研究小組確定了線粒體轉(zhuǎn)移是免疫逃避的關(guān)鍵機(jī)制。這項(xiàng)研究于2025年1月22日在線發(fā)表在《Nature》雜志上。
Togashi教授解釋說(shuō):“我們已經(jīng)發(fā)現(xiàn)線粒體轉(zhuǎn)移是免疫逃避的關(guān)鍵機(jī)制之一。我們的研究為理解腫瘤如何抵抗免疫反應(yīng)增加了一個(gè)新的維度,有可能導(dǎo)致開(kāi)發(fā)更全面、更有針對(duì)性的治療不同癌癥的方法。”
線粒體攜帶自己的DNA(mtDNA),編碼對(duì)能量產(chǎn)生和轉(zhuǎn)移至關(guān)重要的蛋白質(zhì)。然而,mtDNA容易受到損傷,mtDNA的突變可以促進(jìn)腫瘤的生長(zhǎng)和轉(zhuǎn)移。在這項(xiàng)研究中,研究人員檢查了癌癥患者的TILs,發(fā)現(xiàn)它們含有與癌細(xì)胞相同的mtDNA突變。進(jìn)一步的分析表明,這些突變與線粒體結(jié)構(gòu)異常和TILs功能障礙有關(guān)。
利用熒光標(biāo)記,研究人員追蹤了癌細(xì)胞和T細(xì)胞之間的線粒體運(yùn)動(dòng)。他們發(fā)現(xiàn)線粒體通過(guò)稱為隧道納米管的細(xì)胞間直接連接以及通過(guò)細(xì)胞外囊泡轉(zhuǎn)移。一旦進(jìn)入T細(xì)胞,癌癥衍生的線粒體會(huì)逐漸取代原來(lái)的T細(xì)胞線粒體,導(dǎo)致一種稱為“同質(zhì)性”的狀態(tài),即細(xì)胞中所有的mtDNA拷貝都是相同的。
正常情況下,TILs中受損的線粒體通過(guò)一種稱為線粒體自噬的過(guò)程被移除。然而,從癌細(xì)胞轉(zhuǎn)移的線粒體似乎抵抗這種降解。研究人員發(fā)現(xiàn),線粒體自噬抑制因子與線粒體共同轉(zhuǎn)移,阻止了線粒體的分解。結(jié)果,TILs出現(xiàn)線粒體功能障礙,導(dǎo)致細(xì)胞分裂減少、代謝變化、氧化應(yīng)激增加和免疫反應(yīng)受損。在小鼠模型中,這些功能失調(diào)的TILs也表現(xiàn)出對(duì)免疫檢查點(diǎn)抑制劑(一種免疫療法)的耐藥性。
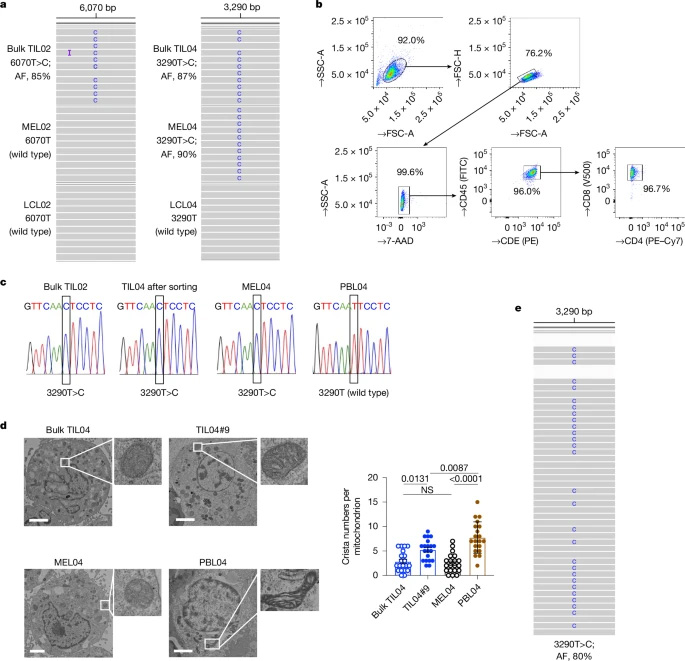
圖2 TIL和癌癥細(xì)胞共享mtDNA突變的線粒體
通過(guò)鑒定線粒體轉(zhuǎn)移作為一種新的免疫逃避機(jī)制,本研究為改善癌癥治療開(kāi)辟了新的可能性。阻斷線粒體轉(zhuǎn)移可以增強(qiáng)免疫治療反應(yīng),特別是對(duì)治療耐藥的癌癥患者。
癌癥治療通常涉及高成本和顯著的副作用,特別是當(dāng)它們無(wú)效時(shí)。通過(guò)抑制線粒體轉(zhuǎn)移來(lái)提高免疫治療的成功率可以減輕癌癥的負(fù)擔(dān)并改善患者的預(yù)后。
Togashi教授總結(jié)道:“現(xiàn)有的癌癥治療方法并非普遍有效,迫切需要能夠克服耐藥性機(jī)制的新療法。開(kāi)發(fā)抑制癌細(xì)胞和免疫細(xì)胞之間線粒體轉(zhuǎn)移的藥物可能會(huì)提高免疫療法的療效,從而為那些對(duì)現(xiàn)有療法有抗藥性的癌癥患者提供個(gè)性化的治療選擇。”
這一發(fā)現(xiàn)為癌癥生物學(xué)提供了令人興奮的新見(jiàn)解,并可能為未來(lái)更有效的治療鋪平道路。
參考資料
[1] Immune evasion through mitochondrial transfer in the tumour microenvironment
摘要:免疫系統(tǒng)在檢測(cè)和摧毀癌細(xì)胞方面起著關(guān)鍵作用。
免疫系統(tǒng)在檢測(cè)和摧毀癌細(xì)胞方面起著關(guān)鍵作用。癌癥免疫療法通過(guò)編程免疫細(xì)胞來(lái)識(shí)別和消除癌細(xì)胞。然而,許多癌癥可以通過(guò)各種機(jī)制逃避免疫監(jiān)視,導(dǎo)致對(duì)治療的抵抗。這突顯了需要更好地了解使免疫逃避成為可能的分子過(guò)程。
腫瘤微環(huán)境(TME)——腫瘤周圍的空間——在癌癥和免疫細(xì)胞之間的相互作用中起著關(guān)鍵作用。癌細(xì)胞可以重塑TME,使其發(fā)揮優(yōu)勢(shì),削弱腫瘤浸潤(rùn)淋巴細(xì)胞(TILs),即攻擊腫瘤的免疫細(xì)胞。線粒體,也被稱為“細(xì)胞的發(fā)電站”,是為各種細(xì)胞過(guò)程產(chǎn)生能量的小細(xì)胞器。它們?cè)诎┘?xì)胞和TILs的代謝重編程中起著重要作用。然而,線粒體功能障礙的確切機(jī)制及其對(duì)TME的影響尚不清楚。
 圖1 腫瘤微環(huán)境中線粒體轉(zhuǎn)移的免疫逃逸
圖1 腫瘤微環(huán)境中線粒體轉(zhuǎn)移的免疫逃逸為了解決這一知識(shí)缺口,日本岡山大學(xué)的Yosuke Togashi教授領(lǐng)導(dǎo)的研究團(tuán)隊(duì)發(fā)現(xiàn)了癌癥免疫逃避中線粒體功能障礙的新見(jiàn)解。與來(lái)自岡山大學(xué)的Noriaki Nishida和Tomofumi Watanabe,以及來(lái)自千葉癌癥中心研究所的Hideki Ikeda、Katsushige Ono和Masayuki Okuno合作,研究小組確定了線粒體轉(zhuǎn)移是免疫逃避的關(guān)鍵機(jī)制。這項(xiàng)研究于2025年1月22日在線發(fā)表在《Nature》雜志上。
Togashi教授解釋說(shuō):“我們已經(jīng)發(fā)現(xiàn)線粒體轉(zhuǎn)移是免疫逃避的關(guān)鍵機(jī)制之一。我們的研究為理解腫瘤如何抵抗免疫反應(yīng)增加了一個(gè)新的維度,有可能導(dǎo)致開(kāi)發(fā)更全面、更有針對(duì)性的治療不同癌癥的方法。”
線粒體攜帶自己的DNA(mtDNA),編碼對(duì)能量產(chǎn)生和轉(zhuǎn)移至關(guān)重要的蛋白質(zhì)。然而,mtDNA容易受到損傷,mtDNA的突變可以促進(jìn)腫瘤的生長(zhǎng)和轉(zhuǎn)移。在這項(xiàng)研究中,研究人員檢查了癌癥患者的TILs,發(fā)現(xiàn)它們含有與癌細(xì)胞相同的mtDNA突變。進(jìn)一步的分析表明,這些突變與線粒體結(jié)構(gòu)異常和TILs功能障礙有關(guān)。
利用熒光標(biāo)記,研究人員追蹤了癌細(xì)胞和T細(xì)胞之間的線粒體運(yùn)動(dòng)。他們發(fā)現(xiàn)線粒體通過(guò)稱為隧道納米管的細(xì)胞間直接連接以及通過(guò)細(xì)胞外囊泡轉(zhuǎn)移。一旦進(jìn)入T細(xì)胞,癌癥衍生的線粒體會(huì)逐漸取代原來(lái)的T細(xì)胞線粒體,導(dǎo)致一種稱為“同質(zhì)性”的狀態(tài),即細(xì)胞中所有的mtDNA拷貝都是相同的。
正常情況下,TILs中受損的線粒體通過(guò)一種稱為線粒體自噬的過(guò)程被移除。然而,從癌細(xì)胞轉(zhuǎn)移的線粒體似乎抵抗這種降解。研究人員發(fā)現(xiàn),線粒體自噬抑制因子與線粒體共同轉(zhuǎn)移,阻止了線粒體的分解。結(jié)果,TILs出現(xiàn)線粒體功能障礙,導(dǎo)致細(xì)胞分裂減少、代謝變化、氧化應(yīng)激增加和免疫反應(yīng)受損。在小鼠模型中,這些功能失調(diào)的TILs也表現(xiàn)出對(duì)免疫檢查點(diǎn)抑制劑(一種免疫療法)的耐藥性。

圖2 TIL和癌癥細(xì)胞共享mtDNA突變的線粒體
通過(guò)鑒定線粒體轉(zhuǎn)移作為一種新的免疫逃避機(jī)制,本研究為改善癌癥治療開(kāi)辟了新的可能性。阻斷線粒體轉(zhuǎn)移可以增強(qiáng)免疫治療反應(yīng),特別是對(duì)治療耐藥的癌癥患者。
癌癥治療通常涉及高成本和顯著的副作用,特別是當(dāng)它們無(wú)效時(shí)。通過(guò)抑制線粒體轉(zhuǎn)移來(lái)提高免疫治療的成功率可以減輕癌癥的負(fù)擔(dān)并改善患者的預(yù)后。
Togashi教授總結(jié)道:“現(xiàn)有的癌癥治療方法并非普遍有效,迫切需要能夠克服耐藥性機(jī)制的新療法。開(kāi)發(fā)抑制癌細(xì)胞和免疫細(xì)胞之間線粒體轉(zhuǎn)移的藥物可能會(huì)提高免疫療法的療效,從而為那些對(duì)現(xiàn)有療法有抗藥性的癌癥患者提供個(gè)性化的治療選擇。”
這一發(fā)現(xiàn)為癌癥生物學(xué)提供了令人興奮的新見(jiàn)解,并可能為未來(lái)更有效的治療鋪平道路。
參考資料
[1] Immune evasion through mitochondrial transfer in the tumour microenvironment



